これまでどちらかに偏ると考えられていたON・OFF症状のメカニズムを研究
株式会社国際電気通信基礎技術研究所(ATR)は7月20日、PTSD患者の脳科学的データをもとに、PTSD症状のダイナミクスを説明する「相反抑制モデル」を世界に先駆けて提案したと発表した。これは、ATR・脳情報通信総合研究所の千葉俊周連携研究員、井手健太郎客員研究員兼しんちクリニック医師、Jessica E. Taylor研究員、ソニーコンピュータサイエンス研究所の小泉愛アソシエートリサーチャー兼ATR客員研究員らの研究グループによるもの。研究成果は、「Molecular Psychiatry」に掲載されている。
画像はリリースより
PTSDは交通事故や震災、洪水、虐待などのトラウマ体験をきっかけとして発症する精神疾患。また、大きな社会不安が蔓延する状況下での新型コロナ感染は、その体験が強烈である場合、PTSDを引き起こす可能性が指摘されている。PTSDはトラウマ体験に関する強い恐怖反応を示す症状(恐怖のON症状)が特徴的な疾患だが、その一方で、恐怖の過剰な抑制による症状(恐怖のOFF症状)を示す場合もある。恐怖をOFF状態にすることは、感情をシャットダウンすることで苦痛から逃れる手段ではあるが、喜びや楽しみなどのポジティブな感情までもOFFにしてしまうため、かえって苦痛が強くなってしまうことも少なくない。恐怖のON症状を主に示す患者は「非解離型」、OFF症状を主に示す患者は「解離型」のPTSDとして診断される。
このようにPTSDは、恐怖のON症状とOFF症状、2つの相反する症状を引き起こす。これまで臨床や研究では、「この患者が主に示すのはON症状なのかOFF症状なのか」という問題に焦点が当てられ、同じ患者はON症状とOFF症状のうち、片方ばかりを示すかのように扱われてきた。しかし、臨床的には多くのPTSD患者で、ON症状とOFF症状の両方がみられる。そこで研究グループは、同じ患者内でのON-OFF間の切り替わりを科学的に示すこと、および切り替わりのメカニズムを説明することに取り組んだ。
PTSD患者の大規模解析において、PTSDの相反抑制モデルを支持
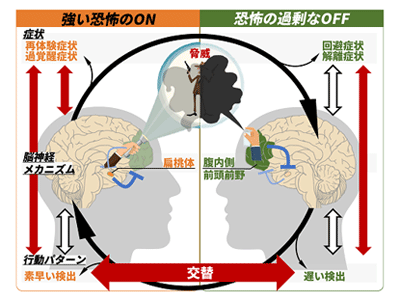
まず、同じPTSD患者が恐怖への過剰な反応(ON行動)と抑制(OFF行動)を交互に示すことを、恐怖刺激を検出するというシンプルな実験課題を通して明らかにした。一般的に、PTSD患者は常に警戒態勢にあり、恐怖刺激を素早く検出すると報告されてきた(恐怖のON行動)。一方で、一部のPTSD患者は恐怖刺激の検出が遅い(恐怖のOFF行動)という報告もあり、前述の症状に関する論争と同様に、ON行動とOFF行動のどちらがPTSDを特徴づけるのかは長年議論されてきたが、研究グループは同じ患者が恐怖刺激を素早く検出するON行動と遅く検出するOFF行動を交互に呈することを示した。また、恐怖のON行動とOFF行動の程度が、各患者のON症状とOFF症状の重症度と関係することを確認し、患者の行動様式だけでなく症状までが連動しながら恐怖のON状態とOFF状態が交替することを明らかにした。
さらに、同一患者における恐怖のONとOFF状態の切り替わりを説明できる脳神経メカニズムのモデルを提唱した。一般的に、拮抗する2つの状態の自発的な交替は、相互に抑制しあう2つの脳領域により説明できることが知られている。そこで、同一の患者における恐怖のON-OFFの交替が、扁桃体という恐怖を促進する領域と、腹内側前頭前野という恐怖を抑制する領域が互いを抑制し合うことで引き起こされる相反抑制モデルを考案し、実際の患者の脳活動データを用いてモデルを検証した。このモデルでは、扁桃体が活発な時は恐怖刺激を素早く検出するON行動が誘発され、恐怖ONの症状が悪化し、一方で、腹内側前頭前野が活発な時は恐怖刺激を遅く検出するOFF行動が誘発され、恐怖OFFの症状が悪化すると予測されていた。
過去に報告されたPTSD症状を示す316人分のデータを用いて大規模解析をしたところ、PTSDの相反抑制モデルを支持する結果が得られた。これらの結果は、従来の「PTSD 患者は一般的に過剰な恐怖反応を示すのか、あるいは過剰な抑制をするのか?」という問いに終止符を打ち、「この患者は、今この時点で、恐怖に過剰反応をする状態にあるのか、抑制する状態にあるのか?」という新たな問いの形を精神医学と脳科学の分野に投げかけるものといえるという。
恐怖の相反抑制モデルは、PTSDだけでなく一般向けにも応用可能
今回の研究で焦点を当てた、「恐怖刺激の検出速度」と「扁桃体の活動性」は、いずれも従来のPTSD治療(持続曝露療法)の効きやすさと深く関係することが知られている。具体的には、恐怖刺激の検出速度が速く、扁桃体が活発なほど治療が効きにくいことが知られている。一方で、扁桃体の活動性が過剰に抑制されている患者群でも同様に治療が効きにくいことが知られている。つまり、扁桃体の活動は強すぎても弱すぎても治療の妨げになり、活動が適度なタイミングで治療を実施することが必要と考えられる。今回の成果を踏まえ、治療の効きやすい適切なタイミングで治療をすることで、従来治療法の効果の飛躍的な向上が期待できる。
また、今回提唱した恐怖の相反抑制モデルは、症状の周期的な変動を説明できるため、アプリなどで患者が日常生活で利用できるようにすれば、症状変動の予測にも役立つ可能性がある。例えば、「6日後にものすごく症状が悪くなりそうだからその前に通院して主治医と相談しよう」というように、患者が自身の症状とうまく付き合い、日常や治療の予定を立てるのに役立つ可能性があるという。
さらに、恐怖を処理する脳回路はPTSDに限らず誰もが持つ脳回路であることから、恐怖のON-OFFを切り替えるメカニズムもPTSD患者とそれ以外の人で共通していると考えられる。そのため、夜中に突然不安になったり、子どもが母親から離れて不安になったりするというような現象を、相反抑制モデルによる恐怖のON-OFFの切り替わりで説明できる可能性があるという。一連のコロナ禍による恐怖や不安と関係した精神的な悪影響が懸念されているが、研究グループは、今回の成果はそれらの影響への予防や対応にも活かせることが期待される、と述べている。




