樹状細胞においてNF-κBの分解を誘導する新たなユビキチンリガーゼを探索
理化学研究所(理研)は8月6日、炎症反応を制御する新たな分子「PDLIM7」を発見したと発表した。この研究は、理研生命医科学研究センター炎症制御研究チームの城道絢テクニカルスタッフI、田中貴志チームリーダーらの共同研究グループによるもの。研究成果は、「Frontiers in Immunology」に掲載されている。
画像はリリースより
ヒトが細菌やウイルスに感染すると、まず免疫細胞の1つである樹状細胞が、細胞膜上のセンサーであるToll(トール)様受容体(TLR)を使ってこれらの病原体を認識し、炎症反応という一連の免疫反応を起こし、侵入した病原体と戦う。樹状細胞による炎症反応の発動には、「NF-κB」という核内の転写因子の活性化が極めて重要であることが知られている。活性化したNF-κBは、炎症性サイトカインなどの炎症反応に必要な多くの遺伝子が順序良く働くように指令を出し、炎症反応の開始と進行に必要不可欠な役割を果たしている。
ところが、このNF-κBが過剰に活性化して、免疫細胞が暴走するような状態が続くと、炎症性疾患や自己免疫疾患を発症することが報告されている。このため、正常な免疫応答を保ちながらこれら疾患の発症を防ぐには、NF-κBの活性をオンにするだけでなく、それを適切な時点でオフにするシステムが重要だ。
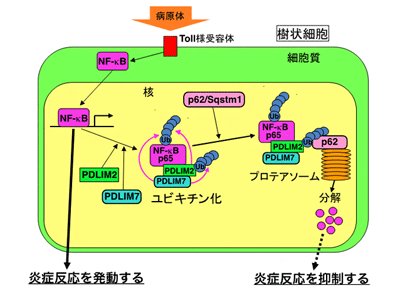
田中貴志チームリーダーらは2007年、核内タンパク質「PDLIM2(PDZ and LIM domain protein 2)」が、樹状細胞においてNF-κBの分解を誘導することにより炎症反応を抑制することを明らかにした。つまり、NF-κBは活性化すると細胞質から核へと移行し、標的遺伝子の転写を誘導するが、PDLIM2は、核内に移行したNF-κBにユビキチンという小さなタンパク質を付加する(ユビキチン化)。ユビキチン化はタンパク質分解酵素の目印となることから、ユビキチン化されたNF-κBは、プロテアソームというタンパク質分解酵素複合体で分解され炎症反応が終息する。田中貴志チームリーダーらは、その後一貫して炎症反応の負の制御機構の分子メカニズムを研究し、樹状細胞における炎症反応の新たな制御因子の探索を行ってきた。
PDLIM2はPDZドメインとLIMドメインという特有の構造を持っており、この2つのドメインを持つタンパク質はPDZ-LIMタンパク質と呼ばれる。PDLIM2は、このうちのLIMドメインを介して、NF-κBをユビキチン化し分解に導く。このように標的タンパク質を選別して結合し、これにユビキチン分子を連結する役割を担う分子をユビキチンリガーゼという。これまでに、PDLIM2を含めて7個のPDZ-LIMタンパク質が報告されているが、PDLIM2以外のPDZ-LIMタンパク質がNF-κBのユビキチン化と分解を誘導するのかについては明らかにされていなかった。
新発見のPDLIM7は、既知のPDLIM2と協調し合って炎症反応を抑制
今回、研究グループは、まずこれらのPDZ-LIMタンパク質がNF-κBをユビキチン化するかどうかを調べた。その結果、7個のPDZ-LIMタンパク質の中で、NF-κBをユビキチン化し、かつ樹状細胞に発現しているのは、PDLIM2とPDLIM7の2つのみであることが明らかになった。次に、PDLIM7のNF-κBに対する作用を調べたところ、PDLIM7は、PDLIM2と同様、NF-κBと結合し、NF-κBをユビキチン化して分解に導くことでNF-κBの働きを抑制した。また、PDLIM7を欠損させた樹状細胞をリポ多糖(LPS)で刺激したときの炎症性サイトカインの産生量を測定したところ、コントロールの細胞と比べて2~3倍に増加しており、同時にNF-κBの分解も妨げられていた。よって、PDLIM7は樹状細胞におけるNF-κBに対する新しいユビキチンリガーゼであり、炎症反応を負に制御することが明らかになった。
これまでに、複数のユビキチンリガーゼが同一の標的タンパク質をユビキチン化する場合、ユビキチンリガーゼが2量体を形成し、相乗的に標的タンパク質の分解を促進することが報告されている。そこで、PDLIM7とPDLIM2という2つのユビキチンリガーゼが、NF-κBをユビキチン化・分解する反応において、どのように働くのかを調べた。その結果、PDLIM7がPDLIM2とも結合し、PDLIM2をユビキチン化することが判明。さらに、ユビキチン化されたPDLIM2とNF-κBの複合体は、このユビキチン鎖を介して、プロテアソーム結合タンパク質として知られているp62/Sqstm1とも結合し、プロテアソームへの輸送が促進されることが明らかになった。実際、PDLIM7とPDLIM2の両方を欠損させた樹状細胞においては、PDLIM7またはPDLIM2のみを欠損させた細胞と比べて、LPSで刺激したときの炎症性サイトカインの産生がさらに2倍増加していた。
以上より、PDLIM7は、NF-κBを直接ユビキチン化して分解に導くだけでなく、PDLIM2によるNF-κBのプロテアソームでの分解を促進することで、より効率的にNF-κBが分解し、炎症反応を負に制御していることが明らかになった。研究グループは、「これらのタンパク質による炎症反応の抑制機構は、炎症性疾患や自己免疫疾患の治療を目的とした人為的な免疫制御法の開発に役立つと期待できる」と、述べている。
▼関連リンク
・理化学研究所 研究成果



