神経変性疾患のメカニズム解明に必須とされる、アミロイド線維の構造形成過程の解明
金沢大学は8月4日、パーキンソン病に特有なアミロイド線維を形成する原因タンパク質であるαシヌクレインが同種間・異種間アミロイド線維を形成する状況の観察に成功し、これまで不明だった神経変性疾患におけるアミロイド線維構造を決定するメカニズムの一端を解明したと発表した。これは、同大ナノ生命科学研究所の中山隆宏准教授、紺野宏記准教授、古寺哲幸教授、安藤敏夫特任教授、理工学域自然システム学類4年(研究当時)の名和真衣佳氏、カリフォルニア大学ロサンゼルス校のデービッド・B・テプロフ教授、昭和大学医学部内科学講座脳神経内科学部門の小野賢二郎教授の国際共同研究グループによるもの。研究成果は、「ACS Nano」のオンライン版に掲載予定(Just Accepted)。
画像はリリースより
アミロイドタンパク質の単量体は、特定の立体構造を形成しない領域(天然変性領域)を持ち、アミロイド線維を形成する過程で、この領域の立体構造を変えることが知られている。この凝集過程は、周囲の物理化学的環境(イオン種と濃度、pHなど)によって影響を受け、1種類のアミロイドタンパク質でも多様な立体構造のアミロイド線維(構造多型)が形成される。各構造型のアミロイド線維は単量体を取り込んで自身と同じ型の立体構造に変換する自己鋳型複製能を持ち、アミロイド線維のこの性質が個別の症状の拡大・伝播に関連するとされている。
一方、体内にはさまざまな物理化学的環境がある。細胞質は中性付近であるのに対し、細胞内小胞は弱酸性だ。酸化ストレスを受けると細胞内は酸性に傾く。これらのさまざまな部位にパーキンソン病の原因タンパク質αシヌクレインが存在し、さらに、アミノ酸配列が一部異なるバリアントも存在する。
このような状況から、アミロイド線維の構造の形成過程の解明が求められているが、一つひとつの線維の立体構造の形成過程を観察する高空間分解能かつ高時間分解能の解明を要するため、これまで明らかにされていなかった。
形成された繊維の元の中から、立体構造が安定して伸長速度の速い構造型が選択されている可能性
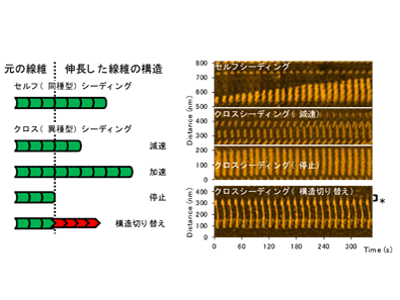
研究グループは、多様な物理化学環境とアミノ酸配列バリアントのモデルとして、パーキンソン病の原因タンパク質αシヌクレインの野生型、家族性パーキンソン病変異型のアミロイド線維を、中性および弱酸性条件で調製し、線維調製条件と同じまたは異なる単量体αシヌクレインを取り込む様子を高速原子間力顕微鏡で観察した。
その結果、線維調製条件と同じ単量体を取り込ませたときと比べて、異種の単量体を取り込む線維伸長では、元の線維と同じ構造で伸長するものの、伸長速度が遅くなったり、早くなったり、あるいは全く伸長しなかったりすることがわかった。
さらに、元の線維と異なる構造で伸長することがあることも明らかになった。これらの結果から、個体内でさまざまな線維の元が形成され、その中の立体構造が安定して伸長速度の速い構造型が選択されていくものと考えられた。
アミロイド形成を特徴とする疾患の分子メカニズム解明や、線維伸長に介入する新薬の開発に期待
アミロイド線維の伸長は、他のアミロイドタンパク質でも共通する特徴が多く、今回の研究は、パーキンソン病やレビー小体型認知症に限らず、アルツハイマー病、プリオン病、2型糖尿病など他のアミロイド形成を特徴とする疾患の分子メカニズム解明にも貢献し得るものと考えられる。研究グループはこれに加え、アミロイド線維伸長に積極的に介入する新薬の開発も期待される、と述べている。
▼関連リンク
・金沢大学 研究トピック



