新生児糖尿病変異の原因となる新規インスリン遺伝子変異としてQ104del変異を同定
東京工業大学は7月29日、マウスのインスリン2タンパク質へのQ104del変異導入による自然発症型の糖尿病モデルマウスを作製したと発表した。この研究は、同大生命理工学院生命理工学系の粂昭苑教授、坂野大介助教、井上愛里大学院生(博士後期課程1年)ら、熊本大学生命資源研究・支援センターの荒木喜美教授、同大ヒトレトロウイルス学共同研究センターの岡田誠治教授、順天堂大学大学院医学系研究科の小池正人教授らの研究グループによるもの。研究成果は、英国科学誌「Scientific Reports」にオンライン掲載されている。
画像はリリースより
膵臓β細胞は、血糖の恒常性維持のために内分泌ホルモンのインスリンを産生分泌する。血糖値を感知し、インスリンを分泌する機能に関与するタンパク質群の遺伝子に変異があった場合には、糖尿病を発症する。従来、インスリン遺伝子において、生後すぐに糖尿病を引き起こすことで知られている変異がいくつか報告されていたが、今回、新生児糖尿病変異の原因となる新規のインスリン遺伝子変異としてQ104del変異を同定した。
一方で、糖尿病の治療には膵臓移植または膵臓内のランゲルハンス島の移植が有効な治療手段だが、ドナー不足がその妨げになっている。そこで、ヒトiPS細胞やES細胞を膵臓細胞へ分化させ移植源とすることが期待されている。試験管内で作製された膵臓細胞の糖尿病治療効果を評価するには糖尿病モデル動物への細胞移植を行い、血糖値の改善効果によって評価することが有効な手法である。
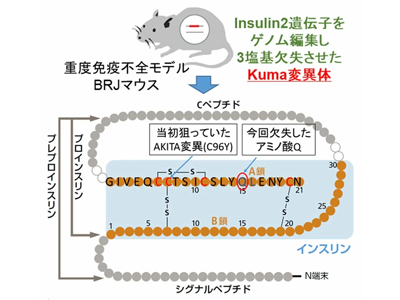
糖尿病モデルマウスを作製する方法としては、薬剤を使ってβ細胞を破壊する方法がよく使用されているが、研究グループは遺伝子変異糖尿病モデルのほうが安定した高血糖状態を作り出せると考えた。従来からよく使われている自然発症糖尿病モデルマウスは重篤な免疫不全の系統ではないため、ヒトの細胞の移植後の生着率を上げる必要があった。そこで、従来のモデルマウスと比べてさらに重篤な免疫不全モデルであるBRJマウスのインスリン遺伝子に変異を導入した重度免疫不全糖尿病モデルを作製することにした。
インスリンを分泌するiPS細胞由来の膵臓細胞を移植、糖尿病の治療効果を評価する動物モデルとして有用
研究グループは当初、ゲノム編集技術の一つであるCRISPR/Cas9システムを使用して重度免疫不全マウスであるBRJマウスのInsulin2遺伝子を編集し、得られたマウスのなかにインスリン2タンパク質の104番目のアミノ酸であるグルタミンが欠失したマウスを得た。このマウスは糖尿病の症状を示したことから、この変異型をKuma変異と名付けた。Kuma変異をもつマウス(Kumaマウス)は、生後4週以降に血糖値が上昇したという。
得られたKumaマウスの解析により、変異インスリンタンパク質の安定性が低く、生後3週以降にKumaマウスの膵臓β細胞におけるインスリンタンパク質の産生量が減少していたことが判明。電子顕微鏡観察結果により、生後3週以降では、Kumaマウスの膵臓β細胞内のインスリン顆粒の数が減少していることがわかった。
さらに、成長とともに膵臓内のβ細胞が減少していく様子も観察された。これらの表現型の変化に伴いインスリンの分泌する能力は失われていくが、インスリンを徐々に放出するチップをマウス体内に入れ、インスリンを投与することで高血糖を是正できることを確認した。
これらの結果から、インスリンを分泌するiPS細胞由来の膵臓細胞を移植し、糖尿病の治療効果を評価する動物モデルとして、このKumaマウスが有用であることが明らかになったとしている。
従来の薬剤投与による糖尿病モデルよりも安定して糖尿病を発症
今回作製した糖尿病モデルマウスは、遺伝的な変異により発症するため、従来の薬剤投与による糖尿病モデルよりも安定して糖尿病を発症することができる。そして、重度免疫不全モデルマウスの系統に遺伝子変異を導入したため、ヒトiPS細胞やES細胞から作製された膵臓細胞の糖尿病治療効果を評価するための細胞移植実験への活用が期待される。
研究グループは今後、ヒトiPS細胞から血糖値に応じてインスリンを分泌できる膵臓細胞(iPS-β細胞)を再生医療に利用し、長期間の治療効果を発揮できるかどうかを判断するためKumaマウスへの細胞移植実験を進めることを予定している。
▼関連リンク
・東京工業大学 ニュース




