遺伝性自己免疫・自己炎症性疾患、I型IFN亢進のメカニズムは不明だった
東北大学は7月29日、COPA異常症モデルマウスを用いて、COPA異常症の炎症病態が自然免疫シグナル(STING経路)の異常な活性化に起因することを明らかにしたと発表した。これは、同大大学院生命科学研究科の向井助教・田口教授らの研究グループによるもの。研究成果は、「Journal of Experimental Medicine」(電子版)に掲載されている。
画像はリリースより
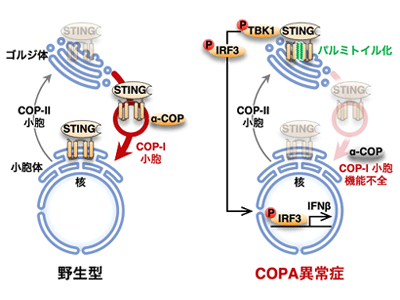
COPAは、Coatomer protein alphaの略で、ゴルジ体から小胞体への輸送を担うCOP-I小胞を形成するタンパク質の1つ。COPA異常症は2015年に発見された常染色体顕性の遺伝性自己免疫・自己炎症性疾患で、関節炎および間質性肺炎を特徴とする難病。ゴルジ体-小胞体間の膜輸送を担うCOP-I複合体のタンパク質因子の一つであるα-COP(遺伝子名:COPA)にK230N、R233H、E241K、D243Gのいずれかの点変異が入ることで発症する。
COPA異常症でI型インターフェロン(I型IFN)応答が亢進していることが報告されており、炎症病態との関連が指摘されていたが、その分子メカニズムは全く不明だった。
COP-I小胞異常<STINGがゴルジ体に蓄積<TBK1とIRF3活性化<IFNβ上昇<炎症
これまでに研究グループは、I型IFN産生経路の一つであるSTING経路の活性化機構を解析し、DNAウイルス感染に伴ってSTINGが小胞体からゴルジ体へ移行し、ゴルジ体でSTINGがパルミトイル化されて下流シグナルが活性化することを明らかにしてきた。
今回、COPA異常症モデルマウスおよび患者由来細胞を用いて、その病態発症の分子メカニズムを解析したところ、野生型細胞ではSTINGは恒常的に小胞体を少しずつ脱出しているものの、常にCOP-I小胞がSTINGをゴルジ体から小胞体に運搬することで、小胞体局在を維持していた。一方で、COPA異常症細胞ではCOP-I小胞による輸送が阻害されてSTINGがゴルジ体に蓄積し、STINGがパルミトイル化することで下流シグナル分子TBK1およびIRF3が活性化され、IFNβ(I型IFNの1種)が発現上昇した。これにより、COPA異常症ではウイルス感染がない状態でもSTINGがゴルジ体に蓄積してしまい、恒常的に炎症応答が惹起されていることが判明した。また、COPA異常症患者由来細胞をSTING特異的パルミトイル化阻害剤H-151で処理したところ、I型IFNの発現が抑制された。
これらの結果から、同研究で用いたSTING阻害剤がCOPA異常症の創薬シーズとなることが期待される。研究グループは、「COPA異常症モデルマウスを用いて、COPA異常症の炎症病態が自然免疫シグナル(STING経路)の異常な活性化に起因することを明らかにした。本研究は、COPA異常症の発症原因を初めて明らかにした重要な報告だ」と、述べている。
▼関連リンク
・東北大学 プレスリリース



