既存薬は標的以外の受容体に働き副作用が出るなど、有効性や安全性に疑念
量子科学技術研究開発機構は7月7日、既存薬よりも性能と安全性を大幅に高めた人工受容体作動薬候補DCZを開発したと発表した。これは、同機構量子医学・医療部門 放射線医学総合研究所 脳機能イメージング研究部(グループリーダー 南本敬史)、国立大学法人京都大学霊長類研究所(所長 湯本貴和)、米国ノースカロライナ大学、米国マウントサイナイ医科大学、および慶應義塾大学医学部(内科学〈神経〉教室 教授 中原仁)らの共同研究グループによるもの。研究成果は、「Nature Neuroscience」のオンライン版に掲載されている。
画像はリリースより
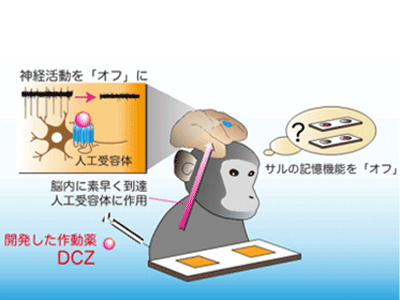
記憶や意思決定などの脳の機能は担当する多くの脳神経細胞の活動によって生み出される。また、神経細胞の活動が不調になると、精神・神経疾患にみられるさまざまな症状を引き起こす原因となる。脳機能や疾患の理解のために、実験動物の神経細胞に「スイッチ」の役割を担う人工受容体を導入し、その人工受容体のみに作用する薬(作動薬)を投与することで特定の神経細胞の働きをオン/オフする手法が用いられている。しかし、この手法で用いられる代表的な作動薬は、作用するまで時間が掛かる、標的以外の受容体に働いて有害な作用(副作用)をもたらすなど、その有効性や安全性に疑念が生じていたことから、これらの課題を克服する新しい作動薬の開発が急務とされていた。
今回研究グループは新しい作動薬デスクロロクロザピン(DCZ)を開発し、その有効性と安全性を動物実験により確認した。
速やかに脳へ到達して高濃度が持続、代謝物は脳には移行しないため、高い有効性と安全性を保持
まず、DCZが脳に素早く移行し、人工受容体に結合するかを確認した。実験には、線条体という脳部位の右側にだけ人工受容体を発現するサルを用いた。DCZを放射線で標識して静脈から投与しPET測定を行ったところ、人工受容体を発現する部位において特に高い信号がみられ、DCZがこの部位に集積することがわかった。また、比較としてこれまでの人工受容体作動薬であるCNOの放射性薬剤を静脈から投与したところ、脳内での信号はほとんどなく、脳にわずかにしか到達しないことが確認できた。同様の結果はマウスにおいても確認できたという。
また、DCZ投与後の脳内にはCNOで見られたような代謝物は検出されず、マウスにおいても同様の結果が確認された。これらのことから、DCZは脳へ速やかに到達して高い濃度が持続する一方、代謝物は脳には移行しないため、高い有効性と安全性を有すると考えられた。
次に人工受容体を発現する神経細胞の活動がDCZによって変化するかを確認するため、興奮性の人工受容体と神経活動に伴い蛍光を発するタンパク質(蛍光カルシウムプローブ)を、マウス大脳皮質の神経細胞に発現させた。神経活動を反映する蛍光強度の変化を二光子顕微鏡で測定しながらDCZを微量投与したところ、蛍光強度は投与後すぐに増加を始め10分後には最大となった。この活動は2時間以上持続し、4時間後には元に戻っていた。この活動の増加は、CNOを100倍量投与した場合に比べて十分に早く、強いことが確認できた。また、人工受容体を持たない神経細胞の活動にはDCZは影響しないことを確認。サルにおいても同様の結果が確認でき、DCZは人工受容体を通じて狙った神経細胞の活動を速やかにピンポイントで変化させることが示されたという。
DCZと人工受容体の組み合わせで動物の脳機能を一定時間、繰り返し操作できるかを確かめるため、サルの記憶機能のひとつである作業記憶を「オフ」にすることを試みた。作業記憶を担当することが知られている脳部位の前頭前野の神経細胞に、抑制型(オフ型)の人工受容体を導入し、その様子をPET測定で画像化することで確認した。作業記憶を評価するためのテストでは、サルが見ている前で左右の穴のどちらかにエサを入れて蓋をし、待ち時間の間カーテンを引いて目隠しをした後、サルにエサが入っている穴を当てさせる。DCZがない条件では、サルはエサが入っている穴を概ね正しく選び、その正答率は待ち時間10秒でも約80%だった。これに対し、DCZを投与すると、待ち時間10秒での正答率が約50%、つまり当てずっぽうで答えるレベルにまで低下し、記憶が保てなくなった。また、DCZ投与の翌日には、正答率はDCZなしのレベルに戻っており、DCZの効果は24時間以内に消失することを確認した。
このように、DCZの微量投与により人工受容体を介してサルの前頭前野などの大きな脳部位の神経活動を抑制し、その脳部位が担当する機能を一時的に「オフ」にできることが確認された。
既存薬の100分の1の量で神経活動を繰り返し安全に調節可能、治療薬などの応用に期待
今回開発された作動薬DCZは、これまでの代表的な作動薬と比べて100分の1の量で神経活動を繰り返し安全に調節できることが実証された。代表的な実験動物であるマウスや、ヒトへの応用前段階の試験で重要視されるサルでの有効性が確認できたことから、今後、脳機能や精神・神経疾患の基礎研究に大きく貢献することが期待される。例えば、うつ病で見られる脳活動状態を作り出すモデル動物を作ることで、治療薬などを開発するなどの応用が考えられる。
さらに、基礎研究から得られた知見をもとに、精神・神経疾患の画期的な遺伝子治療法を進める際にも、即効性が高く副作用リスクの少ないDCZは有力な候補薬物であり、臨床応用の観点からも本研究成果の意義は極めて大きいと考えられる。例えば、てんかんの症状の原因となる異常活動を示す神経細胞にのみ「オフ」にする人工受容体を導入し、症状が出たときだけDCZを投与してすぐに症状を緩和する、などといった応用が考えられるという。
研究グループは、「人工受容体の新しいPET標識薬剤の開発から始まったこの研究は、最終的には作動薬にもなるという大きなプロジェクトとなった。新しい作動薬の開発を待ち望んでいた世界中の多くの研究者から多くの問い合わせが来ており、DCZを利用した化学遺伝学により脳機能研究がさらに発展することを期待している」と、述べている。
▼関連リンク
・量子科学技術研究開発機構 プレスリリース






