IL-17Aが脳内でどのように作用し、ASD病態につながるのか?
筑波大学は6月19日、母体免疫活性化による自閉スペクトラム症(ASD)の発症と病態に重要な役割を持つと考えられている「インターロイキン17A(IL-17A)」をマウス脳室内に直接投与することで、脳内免疫細胞であるミクログリアの活性化とその局在変化が引き起こされることを明らかにしたと発表した。これは、同大医学医療系の武井陽介教授、佐々木哲也助教らの研究チームによるもの。研究成果は、「Molecular Brain」にオンライン公開されている。
画像はリリースより
ASDは、コミュニケーションの障害と常同的行動パターンによって特徴付けられる障害であり、認知機能障害を伴う。アメリカ疾病予防管理センター(CDC)の最近の調査によると、59人に1人がASDであると推定されている。児童期における医療費や特別教育の必要性など経済負担は大きく、ASDの発症メカニズムに基づいた治療法の確立が望まれている。
ASDの要因の一つに母体免疫活性化(maternal immune activation;MIA)がある。MIAは細菌・ウイルス感染によって母体免疫が一過性に活性化される炎症反応であり、胎児の神経発達障害の発症リスクを増大させることが指摘されている。最近の研究結果から、MIAによるASD病態形成における責任免疫分子として、IL-17Aに注目が集まっている。しかし、IL-17Aが胎児の脳内でどのように作用しASD病態につながるのかは、十分にわかっていなかった。
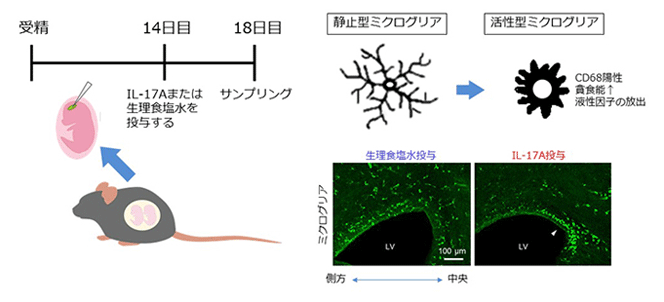
研究チームはこれまで、IL-17Aを産生するヘルパーT細胞(Th17細胞)の分化に必要な分子であるRORγt(レチノイン酸受容体関連オーファン受容体γt)を過剰発現するトランスジェニックマウスを用いて、IL-17Aの中枢神経系への影響を研究してきた。
活性型ミクログリアに神経前駆細胞が過剰に貪食され、大脳皮質形態形成異常が起こる可能性
今回の研究では、IL-17Aが発生中の脳のミクログリア(グリア細胞の1種)にどのような影響を与えるかを直接調べるため、神経細胞産生時期である胚性14日のマウス胎児脳室にIL-17Aタンパク質を投与。そして、誕生直前の胚性18日におけるミクログリアの数と分布をミクログリアマーカーのIba1抗体を用いて検討した。
その結果、対照群(生理食塩水投与群)と比較して、IL-17Aを投与した大脳壁(将来、大脳皮質になる場所)では、ミクログリアの総数は変化しなかったが、外側(一次体性感覚野)よりも内側(帯状回皮質)にミクログリアが多数存在していた。それらのミクログリアは、帯状回皮質の脳室帯・脳室下帯に多く分布しており、細胞体が大きく、突起が短い形態を示した。また、ミクログリアの貪食活性(菌やその他の固形物を取り込む作用)を示すマーカーであるCD68を高発現しており、活性状態にあることがわかった。
今回の研究成果により、IL-17Aに暴露されることで、「ミクログリアが活性化し、貪食能が向上すること」「大脳壁内で帯状回皮質の脳室帯に偏って分布すること」が明らかになった。
脳室帯・脳室下帯には神経前駆細胞が存在する。異所性に分布する活性型ミクログリアにより、神経前駆細胞が過剰に貪食され、ASDに見られる大脳皮質形態形成異常が引き起こされる可能性が示唆された。研究チームは、「本研究が、ミクログリアを標的とした創薬研究や、既存の自己免疫疾患治療薬であるIL-17A抗体のASD予防・治療への応用の手がかりとなることが期待される」と、述べている。
▼関連リンク
・筑波大学 注目の研究




