骨リモデリングにおいて重要な「破骨細胞への分化」、CPEBの役割は?
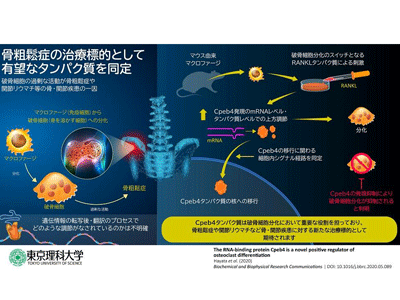
東京理科大学は6月9日、「細胞質ポリアデニル化エレメント結合タンパク質(CPEB)」というRNA結合タンパク質のうちCpeb4が、破骨細胞の分化において欠かすことのできない重要な促進因子であることを明らかにしたと発表した。この研究は、同大大学院薬学研究科修士課程の荒崎恭弘大学院生と同薬学部生命創薬科学科の早田匡芳准教授らの研究グループが、東京医科歯科大学、帝京大学との共同研究として行ったもの。研究成果は、「Biochemical and Biophysical Research Communications」に掲載されている。
画像はリリースより
一般に、遺伝情報が転写されたmRNAは、核外の細胞質に輸送され、そこで翻訳されてタンパク質が生産される。その過程ではmRNAの核外輸送や分解からの保護、翻訳などを可能にするためさまざまな調節因子が関わっている。早田准教授らの研究グループではすでに、mRNAの翻訳を調節する因子であるマイクロRNA(miRNA)の合成酵素の一種が破骨細胞への分化を促す調節を行っていることや、mRNA鎖の末端に存在してmRNA鎖を分解から保護する役割を持つ「ポリA鎖」の分解酵素の一種がmRNAの分解を促し、結果として破骨細胞への分化を抑制する調節を行っていることなど、破骨細胞への分化に関わるさまざまな調節因子の一端を明らかにしてきた。
ある種のポリA鎖分解酵素複合体は、mRNAを取り巻くいろいろなタンパク質と相互作用していることが知られているため、それらのタンパク質も破骨細胞への分化に関して何らかの役割を担っている可能性がある。その1つである「細胞質ポリアデニル化エレメント結合タンパク質(CPEB)」はRNA鎖の安定性に寄与するRNA結合タンパク質で、mRNAの翻訳の活性化や抑制、核内でのRNA鎖の選択的スプライシングに関わるなど多くの機能を持つタンパク質だが、破骨細胞への分化でどのような役割を担っているかは明らかになっていなかった。
Cpeb4がPI3K-Akt・NFAT経路に依存して核内移行し転写制御に関わる
CPEBには4種類(Cpeb1、Cpeb2、Cpeb3、Cpeb4)のファミリーが存在することが知られている。今回の研究ではそれぞれが破骨細胞分化に関係するかどうかを検討するため、マウス由来マクロファージ様細胞RAW264.7、マウス骨髄由来マクロファージBMMをそれぞれ用いて、RANKLによる刺激から0~4日後のそれぞれの遺伝子発現をqRT-PCRによって分析し、タンパク質をイムノブロット法により検出した。その結果、4つのうちCpeb4のみが分化後期に発現量の増加を示すことがわかり、Cpeb4が破骨細胞分化に何らかの役割があると推定された。
そこで、Cpeb4の細胞内分布を明らかにするため免疫蛍光法による分析を実施。その結果、RANKLによる刺激のないRAW264.7細胞ではCpeb4は細胞質のみに分布しているのに対して、RANKLによる刺激から9時間後には、細胞質に加えて一部が核内に移動し、球状や楕円形状に局所的に分布することが示された。核内で局在化する場所は、よく知られているクロマチン間顆粒群やカハール体である可能性が否定されたため不明確ではあるが、CPEBのRNA結合タンパク質としての役割や、核内における選択的スプライシングの役割を考慮に入れると、Cpeb4も核内においてmRNAの選択的スプライシングに関わっている可能性が考えられた。RANKLによる刺激2日後の、Cpeb4遺伝子発現の増加よりもかなり早く9時間後には一部が核内へ移動することは、RANKLによる刺激が最終的にはCpeb4のさらなる増加を促して破骨細胞への分化の過程の最終段階(おそらく前駆細胞同士の融合)に寄与すると示唆される一方、その前にすでに細胞質に存在しているCpeb4の一部が核内に移動して核内でmRNAへの転写に関わる何らかの役割を担っていると考えられた。
このCpeb4の核内への局在化に関わるシグナル経路を調べるために、RANKLによって活性化されることがすでに知られているMAPK・JNK、PI3K-Akt、NFATのそれぞれのシグナル経路を阻害する阻害剤をRANKLと共にRAW264.7細胞に与えて培養した結果、MAPK経路の阻害剤以外ではCpeb4の核内への移動が強く阻害されると判明。すなわちCpeb4の核内への移動は、PI3K-Akt経路およびNFAT経路に依存すると示された。一般的にタンパク質の核内への移動にはタンパク質のリン酸化が伴う。Akt経路はタンパク質のリン酸化に関わっていると知られており、通常はリン酸化から数十分以内でタンパク質の核内への移動が起こる。今回、Cpeb4についてRANKLによる刺激から9時間が必要だったことから、何らかの前段階のステップがあると類推されるものの、これらのシグナル経路によるCpeb4の核内への移動のプロセスが強く示唆された。
Cpeb4は破骨細胞への分化に必須、骨粗しょう症治療薬開発に期待
次に遺伝子サイレンシングのために使用されるshRNAを導入してCpeb4の発現を抑制したRAW264.7細胞を用いたところ、破骨細胞への分化が劇的に抑制され、Cpeb4が前駆細胞から破骨細胞への分化に必須であることが確認された。また、破骨細胞への分化に伴って発現する数種類の遺伝子発現をマーカーとして分析したところ、Cpeb4発現を抑制したRAW264.7細胞においてはRANKLによる活性化と関係する遺伝子発現は全て抑制された。すなわち、Cpeb4の存在がRANKLによって活性化される破骨細胞分化へのシグナル経路に必須であることがわかった。研究グループでは今後、Cpeb4の細胞質、核それぞれにおける詳細な役割と破骨細胞への分化メカニズムを解明することを目指すという。
早田准教授は今回の成果について、「Cpeb4が破骨細胞分化を促進する詳細なメカニズムが今後さらに明らかになれば、骨粗しょう症や関節リウマチなどの骨や関節の病気の病態の解明につながり、さらにはこれらの病気に対する治療薬の開発が期待される。特に骨粗しょう症に悩む高齢者にとってQOLの向上につながる可能性があるのではないかと考えている」と、述べている。
▼関連リンク
・東京理科大学 プレスリリース



