摂食後に起こる、LPSの一過性の血中濃度上昇に着目
東京大学医学部附属病院は5月28日、組織特異的ノックアウトマウスを用いた検討を行い、摂食後の小腸内Lipopolysaccharide(LPS)産生菌の一過性の増加およびインスリン分泌に反応したマクロファージがAkt-mTOR経路の活性化によりインターロイキン10(IL-10)を産生し、IL-10がインスリンとともに肝臓での糖新生遺伝子発現を抑制することを発見したと発表した。これは、東大病院 糖尿病・代謝内科の戸田郷太郎病院診療医、山内敏正教授、糖尿病・生活習慣病予防講座 門脇孝特任教授(研究当時、現・虎ノ門病院院長)、国立国際医療研究センター研究所の植木浩二郎糖尿病研究センター長らの研究グループによるもの。研究成果は、「Molecular Cell」のオンライン版に掲載されている。
画像はリリースより
肥満状態では、免疫反応の活性化により慢性炎症を起こすことでインスリン抵抗性を増強することが、多くの報告により明らかになっている。また、細菌の菌体成分であるLPSは、肥満したマウスで慢性的に増加しており、免疫担当細胞で炎症と関連する遺伝子を含む多数の遺伝子発現を増強することから、肥満を増悪させる因子と考えられてきた。一方で、種々の外的刺激に対する一過性の免疫反応が生体の恒常性維持において重要であるとも考えられるようになってきている。実際に、健康なヒトやマウスでは食事を摂取することによって、一過性にLPSの血中濃度が上昇することが知られている。
研究グループは今回、摂食後におけるLPSの一過性の血中濃度増加、すなわち免疫反応の活性化が、正常な状態で果たす役割を明らかにすることを目的として研究を行った。
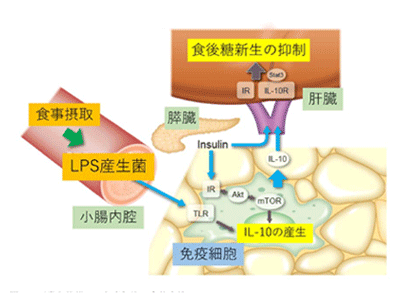
LPS+インスリンでマクロファージがIL-10を産生し、食後糖新生遺伝子発現を抑制
その結果、通常食を摂取した非肥満マウスでは、LPSを産生する腸内細菌が小腸内で一過性に増加していた。一方、門脈内では、LPSに反応して免疫担当細胞が産生する因子のうち、炎症を抑制すると考えられているIL-10の濃度が上昇していた。培養した肝細胞において、食後に門脈内で認められる生理的濃度のインスリン単独では肝糖新生遺伝子が抑制されないが、IL-10との共刺激、またはインスリンとLPSで刺激した骨髄由来マクロファージの培養上清の添加では抑制された。一方で、IL-10ノックアウトマウス由来のマクロファージの培養上清では糖新生遺伝子発現の抑制は見られず、培養した肝細胞の糖新生遺伝子抑制はIL-10とインスリンに依存すると考えられた。また、マウスにIL-10受容体の一部であるIL-10rbに対するshRNAをコードしたアデノウイルスを感染させ、肝臓でのIL-10rbの遺伝子発現を抑制すると、摂食による糖新生遺伝子発現の抑制が障害されたことから、IL-10のシグナルが肝臓での食後糖代謝調節に重要と考えられた。
さらに、免疫担当細胞でのIL-10発現機構を明らかにするために検討を進めると、IL-10はLPSとインスリンの共刺激により、マクロファージで短時間かつ強力に誘導された。この反応はLPSの受容体であるToll-like receptor(TLR)-4の機能が低下したC3H/HeJマウスや、インスリン受容体をノックアウトしたマクロファージで低下していた。また、マクロファージでのIL-10発現はインスリン受容体下流でPI3キナーゼ(PI3K)の阻害薬により低下したことから、PI3K-Akt経路の代謝調節での役割を検討するため、骨髄系細胞特異的Akt1/Akt2欠損マウスを用いた。このマウスのマクロファージでは、インスリン、LPSによるIL-10発現は減弱し、食後の糖新生遺伝子発現抑制が障害された。Aktにより抑制され、mammalian target of rapamycin(mTOR)を抑制するtuberous sclerosis complex(TSC)2がAkt1/Akt2と同時に骨髄系細胞特異的に欠損したマウスではマクロファージのmTORが活性化され、コントロールと同等の摂食反応が見られたことから、マクロファージのAkt-mTORシグナルが食後血糖調節に重要と考えられた。
「Akt-mTOR依存的」なIL-10発現が食後糖代謝調節に重要
高脂肪食を摂取し肥満したマウスでは、内臓脂肪組織マクロファージのインスリン刺激によるAktリン酸化、また、IL-10陽性率が低下しており、食後の糖新生遺伝子発現は抑制されなかったが、アデノウイルスを用いてIL-10を強制発現すると食後血糖は低下し、肝糖新生遺伝子発現は抑制された。さらに、免疫担当細胞由来のIL-10作用を検討するためIL-10ノックアウトマウスから野生型マウスへの骨髄移植実験を行った。このマウスは体重が減少して全身のインスリン感受性が亢進しているにもかかわらず、ピルビン酸負荷試験での食後の糖新生は同等であり、食後の免疫担当細胞由来のIL-10が糖新生を抑制することを支持する結果となった。これらの結果から、マクロファージが食後腸管由来のLPSとインスリンに反応してAkt-mTOR依存的にIL-10を発現し、インスリンと協働して肝糖新生を抑制する経路が生理的な状態での食後糖代謝調節に重要と考えられた。
今回の研究成果により、免疫担当細胞の体外因子に対する反応性を維持することが肥満・糖尿病の新たな治療目標になり得ることが明らかとなり、今後新たなバイオマーカー・治療手法の開発につながることが期待される。
▼関連リンク
・東京大学医学部附属病院 プレスリリース




