近赤外線の薬剤への作用や、反応のスイッチが他でも可能なのかは未解明
北海道大学は5月26日、近赤外線を用いた新規がん治療法である光免疫療法で利用されるIR700という薬剤の光化学的反応過程を解明したと発表した。この研究は、同大大学院理学研究院および同大学創成研究機構化学反応創成研究拠点の小林正人講師、武次徹也教授らの研究グループが、同薬学研究院の高倉栄男講師、小川美香子教授らと共同で行ったもの。研究成果は、「ChemPlusChem」のオンライン版に掲載されている。
画像はリリースより
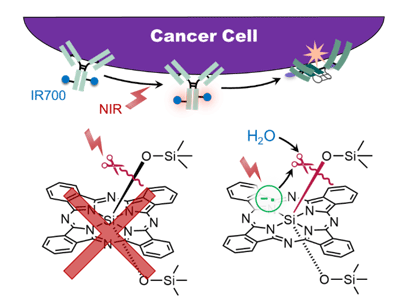
光免疫療法は、がん細胞以外に対してほとんど毒性を示さず副作用の極めて小さい、新しいがん治療法。さらに、がん免疫を合理的に活性化させる効果も発見されており、転移したがんへも有効であるなど、今後のがん治療を大きく変える可能性がある治療法として注目されている。光免疫療法では、IR700という水溶性のケイ素フタロシアニン化合物を結合させた抗体(抗体-IR700複合体)をがん細胞に結合させる。抗体-IR700複合体を投与した後、近赤外光を照射すると、IR700の水溶性の軸配位子が外されて薬剤が凝集することで、薬剤が結合したがん細胞のみを殺すことができる。しかし、近赤外線がどのように薬剤に作用して水溶性軸配位子の切断が起こるのか、また、この反応のスイッチは近赤外線でなくてはいけないのかは未解明だった。
近赤外線は直接反応に関与せず、薬剤を反応しやすい状態にしていた
今回、研究グループは、量子化学計算というコンピュータシミュレーションを用いてIR700を簡略化したモデルでその光化学反応過程を明らかにした。これまでの実験から、反応の進行には近赤外線のほかに電子を与えやすい物質が必要なことが知られていた。これを基に、具体的に4種類の反応過程を考慮して、最も有望な反応過程を提示した。
その結果、IR700の水溶性軸配位子が切断される反応は、化学的にはIR700の周辺にある水分子との反応(加水分解)により起こることが示唆された。この事実は、水分子の中の酸素原子に特別な目印をつけて実験を行ったところ、この目印がついた反応生成物が得られたことで証明された。
また、IR700に近赤外線が照射されるとIR700は励起状態という活性化された状態になるが、この活性化された状態から直接水溶性軸配位子が切断される反応が進行する訳ではないこともわかった。IR700は励起状態になった後、システインなどの電子を与えやすい化学物質から電子を受け取り、「ラジカルアニオン」という状態になる。コンピュータシミュレーションの結果から、IR700のラジカルアニオン状態では、容易に水分子と反応して軸配位子が切断されることが示唆され、また、溶媒の水素イオン濃度により軸配位子切断反応の速度が変化することが予見された。そこで実際に実験を行ったところ、これも証明された。
ラジカルアニオン状態を生成する別の方法が近赤外線の代わりになる可能性
今回の結果から、IR700のラジカルアニオン状態を作り出すことができれば、近赤外線を用いなくても抗体-IR700複合体を用いたがん治療が可能であることが示唆された。
光免疫療法は、がん細胞を選択的に殺傷できる画期的な治療法だが、がん細胞に結合させたIR700に近赤外線を照射することでがんの破壊が開始されるため、近赤外線が届きにくい生体深部のがんに適用するためには、光ファイバーを患部に埋め込むといった侵襲的な処置が必要であり、適用できる部位も限定的となっている。研究グループは、「今回発見されたメカニズムから、ラジカルアニオン状態を生成する別の化学的方法を用いることで、近赤外線を届けることなく光免疫療法を用いたがん治療が行える可能性が高く、治療の適用範囲を飛躍的に拡大することが期待される」と、述べている。
▼関連リンク
・北海道大学 プレスリリース




