膠芽腫の特徴であるネクローシスの、ニッチ形成における役割を解析
東京医科歯科大学は5月13日、悪性脳腫瘍に生じる新しいプログラム細胞死を同定し、がん幹細胞の死産物が腫瘍促進性のマクロファージを誘導するという新たながん再発の仕組みを発見したと発表した。この研究は、同大難治疾患研究所幹細胞制御分野の椨康一助教、田賀哲也教授らの研究グループによるもの。研究成果は、「Stem Cells」オンライン版に掲載されている。
画像はリリースより
日本では高齢化の影響も相まってがんによる死亡者数が増加の一途を辿っている。中でも膠芽腫は極めて予後の悪い難治性の脳腫瘍であり、根治を目指した病態解明と新規治療法の開発が喫緊の課題となっている。一方、がん幹細胞は浸潤・転移、術中診断・放射線化学療法への抵抗性など、がんの悪性形質に関与する重要な治療標的としてその臨床的重要性が確立されているが、その制御によるがんの根治は未だ達成されていない。
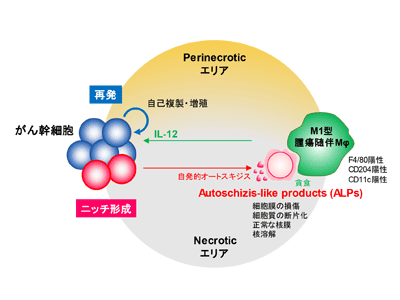
がん幹細胞を取り巻く微小環境(ニッチ)は内皮細胞などの血管構成細胞や、マクロファージ(Mφ)などの免疫細胞から構成され、がん幹細胞の生存・維持に深く関与することから、理論上がん幹細胞の枯渇をもたらす治療標的として高い関心を集めている。これまでにも多くの研究者がニッチの多様な構成要素を明らかにしてきたが、一方でそれらのニッチ要素がどのように形成・維持されるかについては未だ不明な点が多く、ニッチの包括的な理解が十分に進んでいなかった。以前研究グループはがん幹細胞が液性因子を分泌し、骨髄単球からマクロファージへの分化を促すことでがん再発に寄与することを報告した。今回の研究では膠芽腫が病理組織学的に壊死(ネクローシス)を特徴とすることに着目し、ネクローシスのニッチ形成における役割の解明を目指した。
がん幹細胞<オートスキジス様細胞死<死産物がTAM発生促進<がん再発に寄与
研究グループはまず、膠芽腫細胞株の通常培養系において、PI核染色液に高い染色性を示し、かつフローサイトメーター上において比較的小さなサイズを呈する死細胞画分が自発的に産生されていることを見出した。透過型電子顕微鏡を用いた形態学的解析の結果、この死細胞は細胞膜の崩壊とメッシュ状の細胞質、細胞質の断片化と正常な核膜、核膜辺縁へのクロマチンの濃縮などネクローシスのひとつ「オートスキジス(autoschizis)」様の形態を呈していた。またDNA含有量、活性型caspase-3の発現、ミトコンドリア膜電位など生化学的特性を検証したところ、核溶解(karyolysis)とオルガネラの消失を伴う非アポトーシス性の細胞死であることが確認された。オートスキジスは 1995 年にGilloteauxらにより発見されたがん細胞をビタミンCおよびK3で処理した際に生じる誘導性の細胞死。今回見出したこの死産物を、研究グループは「オートスキジス様産物(autoschizis-like products; ALPs)」と命名した。ALPsは移植担癌マウスおよび患者由来細胞の初代培養系からも分離されたことから、膠芽腫に普遍的に生じる自発的細胞死と考えられた。
次に、免疫細胞の関わるニッチ形成・維持機構におけるがん幹細胞由来ALPsの役割を明らかにするため、がん幹細胞および非がん幹細胞より産生されるALPsと骨髄由来Mφの長期培養を行ったところ、ALPsはグリオーマの腫瘍随伴Mφ(tumor-associated Mφ; TAM)マーカーCD204とCD11cを発現するMφに優先的に貪食され、特にがん幹細胞由来の ALPs を添加した場合に誘導されるTAMの生存数が有意に増加することが明らかとなった。すなわち、がん幹細胞はオートスキジス様細胞死を介してTAMの発生を促し、がん幹細胞集団としての自らの生存を図るものと考えられた。
従来抗腫瘍性と考えられていた M1-Mφを高く含む患者群が最も予後不良
さらにALPsに誘導されたTAMの特性を解析するため、既知のM1/M2-Mφマーカー遺伝子の発現を検証したところ、ALPs添加時にM1マーカーのひとつであるIl12b遺伝子の発現上昇が判明。Il12b遺伝子はT細胞の活性化に関わるサイトカインIL12および IL23 の共通サブユニットをコードする遺伝子であることから、ALPs 誘導性のTAMはマーカー上、抗腫瘍性であると考えられた。しかし膠芽腫の再発症例においてはIl12の発現と患者予後が有意に相関し、IL12タンパク質の添加が膠芽腫患者由来がん幹細胞の自己複製・増殖能を有意に促すことも明らかとなり、ALPs誘導 M1-TAMは膠芽腫の再発において促進性の作用を持つと推察された。
最後に、膠芽腫再発患者をM1-Mφを高く含む群・M2-Mφを高く含む群・両タイプの Mφを含まない群に分類し、予後との相関を検証したところ、従来抗腫瘍性と考えられていた M1-Mφを高く含む患者群が最も予後の悪いことが判明。M1/M2 などの既存の生物学的概念の多くは外科的に摘出された初発例から得られた知見に基づくものが多く、がん幹細胞の関与する再発時の事象に対しては既存の概念にとらわれない、より慎重な解釈が必要であると考えられた。
今回の研究により、膠芽腫における自発的ネクローシスの存在が見出され、それらがオートスキジス様の細胞死であることが世界で初めて明らかになった。さらに、それらの細胞死産物は単なる残骸ではなく、がん幹細胞の死産物がTAMの発生を促すことでがん再発に寄与する機能的な役割を有していた。今後このプログラムがん幹細胞死を標的とする根治療法開発への応用が期待される。また、がん幹細胞中にニッチ形成に寄与する亜集団と再発に寄与する亜集団の棲み分けが存在することも示唆された。ニッチ形成に寄与する亜集団は、今後がん幹細胞ニッチの包括的な理解に役立つ新たな手掛かりとして、がん根治療法の開発に向けた研究を飛躍的に促すことが期待される。
▼関連リンク
・東京医科歯科大学 プレスリリース



