腸管の病原菌を強力に殺菌し、感染防御に貢献している「αディフェンシン」に着目
北海道大学は4月30日、自然免疫ではたらくαディフェンシンという抗菌ペプチドが、小腸の上皮細胞であるパネト細胞の小胞体に蓄積したストレスによって異常を起こし、この異常なαディフェンシンが腸管内腔に分泌されることによって腸内細菌の組成が破綻して、クローン病に類似する回腸炎を発症させることを初めて明らかにしたと発表した。これは、同大大学院先端生命科学研究院の中村公則准教授と綾部時芳教授らの研究グループによるもの。研究成果は、国際学術誌「Life Science Alliance」のオンライン版に掲載されている。
 画像はリリースより
画像はリリースよりヒトの腸内には無数の腸内細菌がおり、ヒトと共生して健康維持に深く関係している。最近になって、この腸内細菌に異常が起きると、肥満症や糖尿病などの生活習慣病や免疫系、神経系などのさまざまな疾患の発症につながることが次々と明らかにされ、腸内細菌が健康と疾患との関係で非常に注目されている。しかし、これまでヒトの腸管でなぜ腸内細菌の組成に異常が起きるのか、さらに、その異常がなぜ疾患につながるのかはわかっていなかった。
クローン病は日本で患者数が急速に増加し続けている慢性炎症性腸疾患で、小児期から青年期に発症することが多く、小腸を中心として全ての消化管に潰瘍を伴う炎症を生じ、腸の狭窄を起こして長期間にわたってクオリティ・オブ・ライフの低下を招くことがある疾患であり、病因の究明と根本的な治療法の確立が待たれている。クローン病の患者が腸内細菌叢の異常を伴うことがあるのは知られていたが、その原因はこれまでよくわかっていなかった。
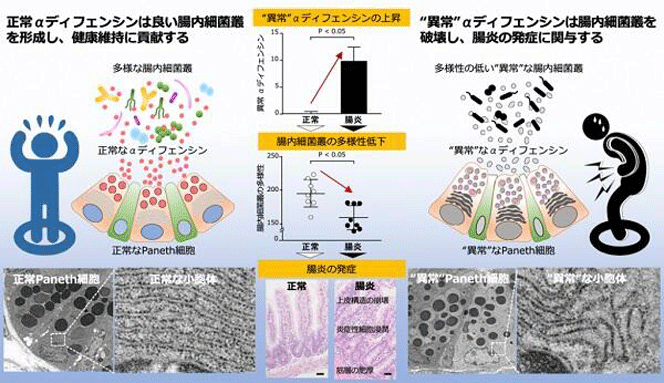
一方、小腸の上皮細胞であるパネト細胞は、αディフェンシンという抗菌ペプチドを腸管内腔に分泌して、病原菌を強力に殺菌することで自然免疫による感染防御に貢献している。さらに研究グループは、この正常なαディフェンシン(酸化型αディフェンシン)が、腸内に常在している共生菌に対してはほとんど殺菌作用を示さないという選択的な殺菌能を持ち、腸内細菌の組成を適切にコントロールしていることを明らかにしてきた。つまり、αディフェンシンは腸内細菌をコントロールすることで健康維持に貢献している。これらのことから、同研究グループの清水研究員らは、クローン病の病因を研究する過程でαディフェンシンに着目し、パネト細胞の小胞体の異常が原因でαディフェンシンに質的な異常(還元型αディフェンシンの分泌)を起こし、そのことが腸内細菌叢の破綻と回腸炎の発症に直接関与しているのではないかとの仮説を立てた。
異常な還元型αディフェンシンが腸管内腔に分泌され、腸内細菌叢の錯乱を引き起こす
研究グループはこの仮説を証明するために、クローン病によく類似する病理学的所見を示す腸管病変を自然発症するSAMP1/YitFcマウスを用いて、まず、病態の進展に伴う腸の炎症所見のスコア化、免疫染色した腸組織の共焦点レーザー顕微鏡観察及び電子顕微鏡観察によるパネト細胞の形態学的評価を行った。次に、αディフェンシンの酸化型と還元型を区別できるように新しく開発した、電気泳動法およびウエスタンブロット法で、ミスフォールディングを起こした異常な還元型αディフェンシンの証明と定量化を行った。さらに、三次元小腸上皮細胞培養系であるエンテロイドを用いた異常パネト細胞の機能解析、腸内細菌の組成の詳細な解析、還元型αディフェンシンの腸内細菌に対する殺菌活性に至るまで、詳細な検討を行った。
小胞体とは、細胞の中で新しく作られるタンパク質の品質管理をしている場所だ。同研究は第1に、クローン病モデルマウスにおいて、パネト細胞の小胞体にストレスが溜まった状態(小胞体ストレス)の異常なパネト細胞が次第に増えていくことを明らかにした。そして、この異常パネト細胞から、正常とは異なり共生菌を殺菌してしまう異常なαディフェンシン(ミスフォールディングを起こしている還元型αディフェンシン)が腸管内腔に分泌されることが原因となって、腸内細菌の組成が破綻して回腸炎を起こす、という一連のメカニズムを初めて解明した。
これまで、クローン病に関しては、患者および各種の腸炎モデルマウスで、パネト細胞における小胞体ストレスと細胞内顆粒の形態異常が報告されていたが、なぜ腸管に炎症が起こるのかについては不明だった。今回の研究により、自然免疫で働くαディフェンシンという抗菌ペプチドの質的な異常(還元型αディフェンシン)がパネト細胞の過剰な小胞体ストレスによって生じ、その異常な還元型αディフェンシンが腸管内腔に分泌されてしまうことで腸内細菌の組成(腸内細菌叢)の錯乱を引き起こし、クローン病に類似する回腸炎が発症することが世界で初めて明らかになった。
生活習慣病、感染症、難治性免疫疾患、神経疾患などの予防・新規治療法開発への貢献に期待
今回の研究成果は、クローン病にとどまらず、腸内細菌叢の異常を伴うことが知られている肥満症や糖尿病などの生活習慣病から各種感染症、難治性免疫疾患、神経疾患まで多くの疾患の予防法および新規治療法の開発に大きく貢献することが期待される。そのためにも今後、臨床研究を加速させる必要がある。
さらに、研究グループのこれまでの研究から、食素材、食成分や腸内細菌代謝物の一部にパネト細胞を刺激して自然免疫を誘導する作用が明らかになっていることから、今後は食品によるパネト細胞の抗菌ペプチドの修復や活性化をターゲットとした健康維持や疾患予防への活用が期待できる。
▼関連リンク
・北海道大学 プレスリリース



