多大な時間・労力・費用がかかる医薬品候補化合物の合成
大阪大学産業科学研究所(産研)は4月24日、がんや神経精神疾患の原因である金属含有タンパク質自身に医薬品候補化合物を合成させる方法を世界で初めて開発したと発表した。この研究は、産研の鈴木孝禎教授、京都府立医科大学大学院医学研究科の伊藤幸裕准教授、京都大学大学院医学研究科の内田周作特定准教授らの研究グループによるもの。研究成果は、米国科学誌「ACS Catalysis」にオンライン公開されている。
画像はリリースより
医薬品は、病気の原因であるタンパク質に結合することにより、その薬効を発する。昨今の医薬品開発では、数十万~数百万個の化合物ライブラリーをスクリーニングすることにより、リード化合物を得て、病気の原因である標的タンパク質の結晶構造をもとにした分子設計(Structure Based Drug Design, SBDD)により、その誘導体を設計、合成して構造最適化を行う方法が頻繁に用いられている。
しかし実際には、標的タンパク質が非常に柔軟で、化合物によって構造を大きく変えてしまう場合や、標的タンパク質の結晶化が困難な場合が多いため、リード化合物の類似化合物を広範に一つひとつ合成し、それらの活性を測定することにより、構造の最適化を行う方法を取らざるを得ない。しかも、このようにして合成された候補化合物のうち、実際に薬になるのは、わずか3万分の1に過ぎない。このように、医薬品創製研究には、多大な時間と労力、費用がかかるという実態から、有用で高活性な医薬品候補化合物を短時間で合成する新たな戦略が切望されている。
通常6か月以上かかるところを、わずか2日で、うつ病治療薬候補化合物の発見に成功
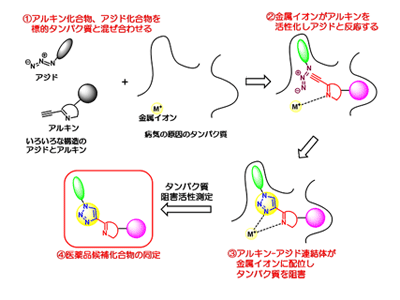
研究グループは今回、がんや神経精神疾患の原因である金属含有タンパク質に着目し、次の(1)~(4)のステップにより、効率的に医薬品候補化合物が見出せることを示した。(1)金属イオン(M+)に1か所で配位できる単純なアルキン化合物といろいろな構造を持つ単純なアジド化合物を標的タンパク質と混ぜ合わせる。(2)標的タンパク質中の金属イオン(M+)に配位したアルキン化合物とタンパク質のポケットに納まったアジド化合物は効率的に反応し、アルキン-アジド連結体(トリアゾール体)を生成する。(3)トリアゾール体は、標的タンパク質のポケットに納まり、かつ金属イオン(M+)に対して2か所で強く配位できるので、標的タンパク質を強力に阻害する。(4)そのままタンパク質の活性評価を行うことにより、トリアゾール体が医薬品候補化合物として同定できる。なお、標的タンパク質に納まらない、もしくは、納まりにくいアルキンとアジド化合物の組み合わせではトリアゾール体は生じることがなく、医薬品候補化合物とはならない。同手法を用いることで、複数のアルキン化合物(m個)とアジド化合物(n個)の組み合わせ(m×n個)を短時間で評価することが可能だ。そのため、化学者がm×n個の化合物を一つひとつ合成する必要がなく、効率的に医薬品候補化合物を探索することができる。
実際に、従来の方法では6か月以上かかるところを、同手法を用いることで、わずか2日で、うつ病治療薬候補化合物を見出すことに成功した(特願2019-106166)。同手法を用いることで、短時間かつ少ない労力で、画期的新薬の創出が期待される。
研究グループは、「難治性疾患に対する新薬の早期開発が望まれる一方で、働き方改革が推進され、創薬研究者は効率的に効果の高い新薬を開発する必要に迫られている。今回、われわれが開発した創薬手法が創薬研究者に広く利用され、革新的新薬の創出が早期に行われることを期待している」と、述べている。
▼関連リンク
・大阪大学 産業科学研究所 Hot Topics




