Aβ産生に関わるγセクレターゼの活性制御の仕組み解明へ
日本医療研究開発機構(AMED)は4月20日、東京大学を中心とする研究グループが、アミロイドβ(Aβ)産生に関わる新規分子として「calcium and integrin-binding protein 1」(CIB1)を同定し、そのAβ産生制御メカニズムを明らかにするとともに、初期アルツハイマー(AD)患者の死後脳において、CIB1発現量が低下していることを見出したと発表した。これは、東京大学大学院薬学系研究科の富田泰輔教授、堀由起子講師、邱詠玟大学院生らと、新潟大学脳研究所の池内健教授らによるもの。研究成果は、「The FASEB Journal」に掲載されている。
画像はリリースより
ADに特徴的で最初期に見られる病理学的所見として、Aβの脳内での凝集・蓄積が挙げられる。これまでの多くの遺伝学的研究から、このAβの凝集・蓄積が神経細胞内にタウの凝集・蓄積を引き起こし、神経変性に至ることが示唆されている。そのため、Aβ産生機構の詳細な理解は、AD発症の最初期過程の解明につながると考えられている。Aβは、アミロイド前駆体タンパク質(APP)がβセクレターゼとγセクレターゼによって2段階の切断を受けることで産生される。このうちγセクレターゼによる切断は、その切断部位によってAβのC末端に多様性をもたらし、ADの発症に関わる凝集性の高いAβ分子種の産生に関与することから、γセクレターゼの活性制御はADの治療標的として重要と考えられている。しかし、その切断制御機構には未だ不明な点が多くある。
「CIB1」発現量低下<γセクレターゼ細胞内局在亢進<Aβ産生増加<AD発症の可能性
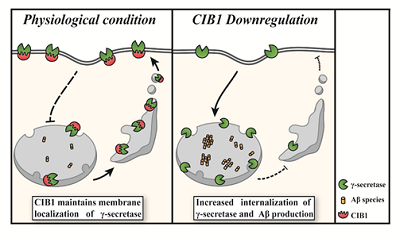
研究グループは、Aβ産生に関わる新規分子の同定のため、近年開発されたゲノム編集技術であるCRISPR/Cas9システムを用いて、ゲノムワイドスクリーニングを実施。その結果、Aβ産生を負に制御する新規分子として「CIB1」の同定に成功した。CIB1をノックダウンやノックアウトしてタンパク質量を減少させると、Aβ産生量は上昇することが確認された。
免疫共沈降実験により、そのメカニズムとして、CIB1がγセクレターゼと相互作用していることがわかった。また、CIB1はγセクレターゼの総量には影響を与えない一方で、γセクレターゼの細胞表面膜の存在量に影響することもわかった。このことから、CIB1は、生理的条件下では、γセクレターゼと相互作用し、γセクレターゼを細胞膜に留めていることが示唆された。一方、CIB1発現量減少下においては、この機能が失われ、γセクレターゼの内在化が亢進することが考えられる。これまでの研究から、γセクレターゼの細胞内局在がその切断活性に影響を与えることがわかっている。すなわちCIB1がγセクレターゼの細胞内局在を変化させることで、Aβ産生を制御していることが示唆された。
次に、AD発症プロセスにおけるCIB1の役割を検討する目的で、ヒトAD患者の死後脳サンプルについてシングルセルRNA-seq法による解析を行った。その結果、初期ADステージの神経細胞においてCIB1の発現量が減少していることが確認された。これらの結果は、神経細胞におけるCIB1発現量の減少により、Aβ産生量が上昇し、AD発症プロセスを加速する可能性を示唆している。
AD発症早期ステージにおいては、CIB1の発現変動によりγセクレターゼの細胞内局在が変容し、Aβ産生が上昇することで、AD発症過程を加速することが示唆された。「今後、このCIB1を標的とした新たなAD治療・予防戦略の提示、早期診断法の開発につながることが期待される」と、研究グループは述べている。
▼関連リンク
・日本医療研究開発機構 プレスリリース






