抗原多型が少なくワクチンとして有望なPfRipr、大きすぎるのが課題
愛媛大学は4月21日、現在新規熱帯熱マラリア発病阻止ワクチンとして非臨床開発をすすめているPfRipr5ワクチンの作用メカニズムの解明に成功したと発表した。この研究は、同大プロテオサイエンスセンターの長岡ひかる特別研究員、高島英造准教授、坪井敬文教授、大日本住友製薬株式会社の福島晃久シニアフェローらの研究グループによるもの。研究成果は、「Scientific Reports」に掲載されている。
画像はリリースより
マラリアは、蚊で媒介される寄生虫病で、2018年には依然として世界で2億人以上がマラリアに罹り、死亡者数も40万人以上に及んでいる。マラリアワクチンの開発は、この40年以上取り組まれてきたが、蚊からヒトへの「感染を防ぐ」、第一世代のマラリア感染阻止ワクチンの効果は約30%と低く、より有効な次世代マラリアワクチンが切望されている。一方、マラリア原虫の赤血球への侵入を阻害することによってマラリアの「発病を防ぐ」、発病阻止ワクチンは、流行地におけるマラリア防御の切り札と考えられているものの、ワクチン抗原に対する流行地マラリア原虫の抗原多型のため、研究開発が進んでいなかった。
研究グループはこれまでに、熱帯熱マラリア原虫由来の新規の発病阻止ワクチン候補抗原PfRiprには抗原多型が少ないことを見出し、この抗原を用いたワクチンができれば高い有効性が期待できると考えていた。しかし、PfRiprはワクチンとしてタンパク質全体を合成するにはサイズが大きすぎる(1,086個のアミノ酸から構成)ため、ワクチン開発のためにはPfRiprのワクチン至適部位の探索と、ワクチン開発に必須の作用メカニズムの解明が課題となっていた。
分断体PfRipr5が標的、その抗体による原虫の赤血球侵入阻害活性を確認
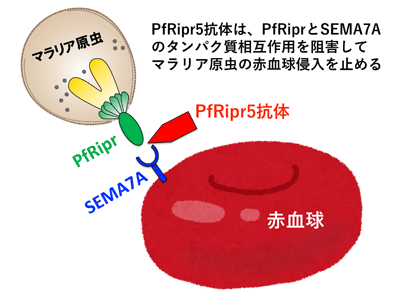
今回、研究グループは、「PfRipr全長中のワクチン至適部位」および「PfRiprワクチンの作用メカニズム」の解明を目指し、PfRiprと相互作用する赤血球タンパク質を探索。まず、PfRipr全長から約200個のアミノ酸から成る11種類の分断体タンパク質をコムギ無細胞タンパク質合成法により作製し、それぞれに対するラット抗体の熱帯熱マラリア原虫赤血球侵入阻害活性を測定した。その結果PfRipr全長中の侵入阻害活性部位はPfRipr5領域の1か所のみに存在し、PfRipr5抗体はPfRipr全長抗体と同等以上の優れた侵入阻害活性を示した。したがって、PfRipr5は熱帯熱マラリア発病阻止ワクチンとして有望であるとわかった。
次に、コムギ無細胞タンパク質合成法により主要なヒト赤血球表面タンパク質を13種類作製し、PfRiprとのタンパク質相互作用を探索。その結果、組換えPfRiprタンパク質がSEMA7A組換えタンパク質、および赤血球のSEMA7Aタンパク質と結合することがわかった。さらに、PfRipr5に対する抗体は、PfRipr-SEMA7Aタンパク質相互作用を阻害した。したがって、PfRipr5ワクチンの作用メカニズムとしては、PfRipr5抗体がマラリア原虫PfRiprと赤血球SEMA7Aとのタンパク質相互作用を阻害することにより、ワクチン効果を発揮していることが示唆された。
研究グループは、「現在非臨床開発中のPfRipr5マラリアワクチンの効果を評価する際、これまでの動物実験に加えてin vitroにおけるPfRiprタンパク質とSEMA7Aタンパク質との相互作用の阻害試験も実施することが可能となり、PfRipr5ワクチン開発を加速することができる」と、述べている。
▼関連リンク
・愛媛大学 プレスリリース



