四次元計測と数理解析で心臓初期発生のCルーピングを明らかに
理化学研究所(理研)は4月16日、心臓の初期発生で見られる左右非対称の「ループ状構造」が、心臓を作る「細胞そのものの再配列」という内因的かつ動的な要因により形成されることを明らかにしたと発表した。この研究は、理研生命機能科学研究センター発生幾何研究チームの森下喜弘チームリーダー、大塚大輔上級研究員、川平直史大学院生リサーチ・アソシエイト(研究当時、現 京都大学大学院医学研究科博士課程大学院生)らの研究グループによるもの。研究成果は、「Cell Reports」オンライン版に掲載されている。
心臓は、複雑かつ左右非対称な三次元構造を持つ。その発生は、「心筒」と呼ばれる真っすぐな管状の構造の形成から始まり、それが体の右側に飛び出した「ループ状構造」へと変化し、明確な左右非対称性が現れる。このプロセスは、心筒がCの字となることから「Cルーピング」と呼ばれる。これまで、Cルーピングを説明するための2つの有力なモデルが広く受け入れられてきた。1つは、心筒がまず腹側に曲がり、飛び出した後に右側に回転するという「Ventral bending and rotationモデル」、もう1つは、心筒が限られた体内空間において長軸方向に伸び、両端からかかる力が徐々に増大することにより、急激に大きくたわむという「Physical Bucklingモデル」だ。これらのモデルはいずれも、心筒の長軸伸長と心筒の両端における境界条件(心臓に接続する血管からもたらされる左右非対称な細胞の流入や力の負荷)が、右側へのループを引き起こす主要なメカニズムであると仮定している。
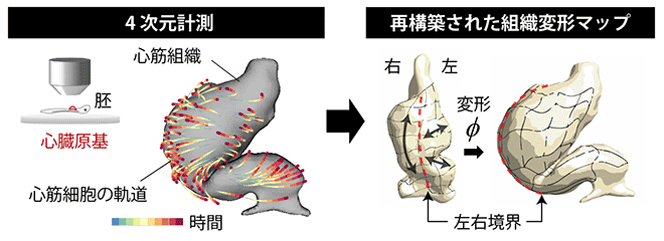
近年の顕微鏡技術やデータ解析技術などの進歩は、こうした過去に提案されてきた仮説モデルのどちらが正しいのかという問題に対する、客観的なアプローチを可能にしつつある。特に、発生初期の臓器は数千個の細胞がもととなって形を作っており、そこで起きている細胞の振る舞いを1細胞の解像度で計測・解析することが可能となった。心臓の発生を高解像度で4次元(空間3次元+時間1次元)観察することは、これまで困難だった。そこで研究グループは今回、心臓のライブイメージングと、先行研究で開発した細胞軌道情報から臓器形態の変形過程を再構築する数理的手法注を用いて、心臓の初期の形ができるCルーピングを組織レベルと細胞レベルの2つのスケールから明らかにすることを目標とした。
画像はリリースより
従来の2モデルとは異なり心筒の構成組織自体が異なる方向へダイナミックに変形
発生中の心臓の変形過程を算出するためには、臓器の形状データと、内部の細胞の軌跡データが必要となる。研究グループは、ヒトと同じ二心房二心室型の心臓を持ち、器官発生の観察が容易なニワトリ胚を用いた。心筒を蛍光色素で、心筒を構成する心筋細胞を蛍光タンパク質で、それぞれ異なる色でラベルし、二光子顕微鏡によるタイムラプスイメージングを行った。
まず、Cルーピングの過程をさまざまな方向から観察することで従来のモデルの検証を試みたところ、「Ventral bending and rotationモデル」が提唱する心筒の腹側への屈曲は、実際にはごくわずかにしか起きていないと判明。また、心筒は全体として確かに右側へと回転するが、心筋細胞ごとの回転量は、場所によって異なっていることもわかった。これらの観察結果から、Cルーピングは固いチューブが一体となって折れ曲がったり回転したりするような単純な現象ではなく、心筒そのものの変形を伴うものである可能性が示された。
そこで、計測データをさらに詳細に解析し、Cルーピングが起こる際の心筒の変形過程を再構成して局所的な変形量を求めた。その結果、心筒を構成する左右の心筋組織が異なる方向に伸長していると判明。右側では、心筋組織が心筒の長軸方向に沿って伸びるのに対し、左側では、心筒の周長に近い方向に伸びることで、ループ状構造が形成されることが明らかになった。
これまで想定されていた2つのモデルでは、心筒左右両端からの細胞流入による長軸方向への伸長と、心筒の頭側および尾側での境界条件がループ形成に重要だと考えられていたが、今回の解析結果は、境界条件の重要性よりはむしろ、心筒を構成する組織自体が異なる方向へダイナミックに変形することでループ状構造が形成されることを示している。
右側の心筋組織では「細胞の再配列」、左側では「細胞の形状変化」
次に、左右の組織が異なる方向に伸長するのは、どのような細胞プロセスによって実現されているのかを知るために、考えられるさまざまな細胞の振る舞い(細胞の増殖、細胞の大きさ・形の変化、細胞の再配列、細胞死)をそれぞれ測定。過去の研究での重要な知見から、細胞増殖や細胞死がCルーピングに与える影響は少ないことが示されている。事実、今回も、細胞増殖を止めてもCルーピングが起きることが確認された。そこで、細胞の大きさ・形の変化と、細胞の再配列のそれぞれが、左右で異なる組織変形量にどれくらい寄与するかを算出。その結果、右側の心筋組織では、細胞が並び替わることによる「細胞の再配列」が長軸方向の伸長に大きく寄与し、左側の心筋組織では、「細胞の形状変化」が心筒の周長に近い方向への変形に大きく寄与することが明らかになった。
細胞の再配列は、形態形成のさまざまな場面で観察される現象であり、細胞骨格であるアクチンが関与していることが知られています。また先行研究では、アクチン重合を阻害するとCルーピングが起きずに、心筒が左右対称な太い管となることが示されている。そこで、心筋細胞のアクチン重合を実験的に阻害し、そのときの細胞の振る舞いを調べてみると、右側組織で見られていた心筒の長軸方向の伸長をもたらす細胞の再配列が消失した。このことから、Cルーピングは、アクチン重合に依存して細胞集団が頻繁に並び変わる「細胞の再配列」で実現されていることが明らかになった。この結果は、一度形成された心筋組織の管が、静的に保たれているのではなく、管を形成する心筋細胞集団が次々と並び変わることで自ら形を作っているという、従来想定されていたモデルよりもはるかにダイナミックな描像を明らかにした。
今回の研究成果は、「臓器の形がどのように作られるのか」という生物学上の根本問題を、実験と理論の融合研究、および組織と細胞という異なる階層間の定量比較解析で解き明かしたもの。研究グループは、「今後、同様の解析が、心臓以外の臓器や、先天性疾患・奇形の発生機序の解明に応用されると期待できる」と、述べている。
▼関連リンク
・理化学研究所 プレスリリース



