COVID-19によるARDSは致死率が高く、治療法の開発は緊急の課題
量子科学技術研究開発機構は4月15日、新型コロナウイルス感染症(COVID-19)で生じる急性呼吸器不全症候群(ARDS: Acute Respiratory Distress Syndrome)が、サイトカインストームにより発症するサイトカインリリース症候群(CRS: Cytokine Release Syndrome)である可能性とそれを防ぐ治療標的としてIL-6-STAT3経路を提唱したことを発表した。これは、同機構の平野俊夫理事長が、北海道大学遺伝子病制御研究所の村上正晃教授と共同で、これまでの長年の研究成果を基に個人的な活動として論文発表したもの。研究成果は、米国の免疫学雑誌「Immunity」5月号に掲載予定で、既にオンラインで先行掲載されている。
画像はリリースより
昨年12月に中国で発症した新型コロナウイルス感染症(COVID-19)は、パンデミック感染症となり、4月14日現在世界中の感染者は190万人、死者は12万人に達した。一刻も早くワクチンや治療薬を開発するための取組が世界中で行われている。特にARDSは致死率が高く、治療方法の開発は緊急の課題である。新型コロナウイルス(SARS-CoV-2)感染に関する最新の論文は「Zhouら、Nature 2020年3月12日号」「Hoffmannら、Cell 2020年4月16日号」の2編だ。
ZhouらとHoffmannらが明らかにしたのは以下の3点。1)SARS-CoV-2の表面に存在するスパイクタンパク質は、細胞表面のACE2を受容体として結合するが、細胞内に入って感染するためにはスパイクタンパク質が細胞表面のTMPRSS2により切断される必要がある。2)その後切断されたスパイクタンパク質がウイルス膜と細胞膜の融合を引き起こす結果、ウイルスはACE2とともに細胞内に取り込まれる。3)TMPRSS2の阻害剤はウイルス感染モデル実験系においてウイルスの細胞内取り込みを阻止した。またACE2に対する抗体もウイルスの細胞内取り込みを阻止した。
一方、研究グループは、これまでにIL-6-STAT3系がどのように自己免疫疾患、炎症性疾患を誘導するかの研究を行い、炎症誘導の基盤として「IL-6アンプ」を報告した。この機構は、気管支・肺胞上皮細胞、線維芽細胞や血管内皮細胞などの非免疫細胞に存在し、NF-kB経路とSTAT3経路の同時活性化によって種々の炎症性サイトカインやケモカイン、増殖因子などを病態局所で大量に持続的に産生するもの。さらに、炎症状態では、主要なSTAT3活性化因子はIL-6であることが示唆されている。このIL-6アンプは関節リウマチなどの慢性炎症性疾患や、自己免疫疾患、がんなどに関与している。最近では、最先端がん治療のひとつであるCAR-T細胞療法の副作用であるサイトカインストームが原因の致死性のサイトカインリリース症候群(CRS: Cytokine Release Syndrome)の治療にも抗IL-6Ra抗体などIL-6-STAT3経路の遮断が使用されている。
感染<NF-kB/STAT3<IL-6アンプ<サイトカインストーム<ARDS発症
研究グループは、これらの知見に基づき、これまでの同研究グループや他の研究グループの研究成果を含めて総合的に考察した。その内容は、以下の通り。
SARS-CoV-2とACE2との結合を抑制する分子や、TMPRSS2の阻害剤はウイルス感染を抑制する効果が期待され、ウイルス感染の初期には有効な治療薬になる可能性がある。また、スパイクタンパク質に対する抗体、スパイクタンパク質以外のウイルス膜タンパクに対する抗体、サーズウイルス(SARS-CoV)や新型コロナウイルスから治癒した患者に存在する抗体なども感染抑制効果が期待される。一方、感染後期に生じる致死的なARDSは、ウイルスが減少し始めた頃に生じるので、過剰な生体反応のCRSである。
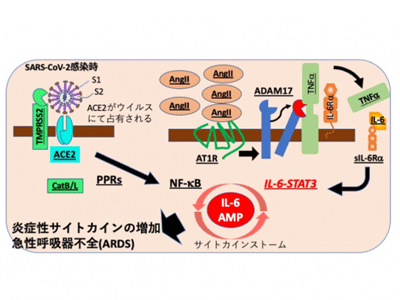
生体にSARS-CoV-2などの外来ウイルスが感染すると自然免疫の受容体であるPattern Recognition Receptors (PRRs)がウイルス由来核酸などで活性化され自然免疫が活性化される。SARS-CoV(SARS-CoV-2と遺伝子配列の相同性は約80%)の感染では、PRRsのRIG-1やMDA5が活性化されてMYD88を介して転写因子NF-kBが活性化される。その結果、TNFα、IL-1、IL-6やタイプ1インターフェロン産生が誘導される。TNFαやIL-6は樹状細胞、マクロファージや好中球などの自然免疫細胞を活性化する。この自然免疫活性化に引き続き獲得免疫が活性化されてウイルスを排除する。新型コロナウイルスのような新規のウイルスでは、獲得免疫の免疫記憶がないのでウイルスの完全な排除には時間がかかる。基礎疾患などを含めて何らかの原因で、ウイルス排除のための免疫反応、炎症反応が過剰に激しくなると肺胞上皮細胞などの細胞死も生じて、全身性のサイトカインストームからCOVID-19に見られる致死的なARDSが起こる。
SARS-CoV-2感染の場合、その細胞受容体であるACE2が関連する経路も活性化して炎症誘導に関連する。前述したように、SARS-CoV-2が細胞に感染すると細胞膜上のACE2発現が減少し、そのリガンドであるアンジオテンシン2(AngII)が増加し、アンジオテンシン受容体タイプ1(AT1R)との結合を介して炎症増強作用を発揮する。実際、SARS-CoVによるARDSがAT1R阻害剤で阻止できることも報告されている。
AngII-AT1R経路は血圧を上げる作用があるが、この経路は細胞膜上のタンパク質分解酵素であるADAM17を活性化し、細胞表面状の膜型TNFαやIL-6受容体α(IL-6Ra)を切断し、可溶性TNFαや可溶性IL-6Rα(sIL-6α)が放出される。TNFαはその受容体を介して、PPRsの刺激と同様に転写因子NF-kBを活性化し、IL-6など標的分子を誘導する。IL-6-sIL-6R複合体は、非免疫細胞に作用し転写因子STAT3を活性化する。その結果、肺胞上皮細胞を含む非免疫細胞では、NF-kBとSTAT3の同時活性化が生じ、過剰なNF-kB刺激がIL-6アンプとなり炎症性病態を形成する。IL-6アンプは活性化すると自身をさらに活性化するというポジティブフィードバック機構を有しており、一旦活性化されると際限なく活性化される。その結果サイトカインストームが誘導されCRSが発症する。
治療薬の標的としてIL-6 アンプが有望
研究グループは、今後の展開について、「COVID-19に生じる致死的なARDSはCRSであり、CRSを治療することができればCOVID-19も恐ろしい病気ではなくなる。治療薬開発の有望な標的としてTMPRSS2、ACE2、AT1R、ADAM17、TNFα、そしてIL-6アンプで重要な役割を果たしているIL-6-STAT3経路などが考えられる。特に、感染後期に見られる致死的なARDSの治療には、すでにCAR-T治療におけるCRSの治療に使用されており、かつIL-6アンプを阻害できる抗IL-6受容体抗体も有望である」と、述べている。
▼関連リンク
・量子科学技術研究開発機構 プレスリリース



