腎がん進展に、がん微小環境内の血管内皮細胞や免疫細胞などが関わると予測
東京大学は3月24日、腎がん肺転移の分子メカニズムについて、活性化された好中球が肺転移の成立に重要な働きをしていること、また、マウス実験からBET阻害剤により肺転移を抑制できることがわかったと発表した。これは、同大大学院医学系研究科の西田純特任研究員(研究当時)、江帾正悟准教授、宮園浩平教授らの研究グループによるもの。本研究成果は「Nature Cell Biology」オンライン版に掲載されている。
画像はリリースより
腎がんは、世界において成人の罹患するがんのうち2~3%を占めている。無症候で進展するがんとしても知られ、診断時に転移性腫瘍を有する症例は30%以上に上る。主な組織型は淡明細胞型腎細胞がんであり、肺、骨、脳あるいはリンパ節に転移する。早期腎がん症例は鏡視下手術もしくは開放手術による根治的腎摘除術が奏功し、良好な治療成績が得られている。一方、転移を有する進行腎がんの症例に対しては、分子標的治療薬も使用されている。
進行腎がんの症例に対する分子標的治療薬としては、血管新生阻害剤やチロシンキナーゼ阻害剤などが挙げられる。また一部の腎がんでは分子標的治療薬の登場以前よりサイトカイン療法が奏功することが知られ、近年でも免疫チェックポイント阻害剤が著効を示す場合があることが明らかになっている。こういった事実から、腎がんではがん微小環境に存在する血管内皮細胞や免疫細胞などが、がんの進展に密接に関わることが想定され、これらの細胞とがん細胞との関連性を理解することで、腎がんの新しい治療法の創出につながることが期待されている。
マウス実験で、進行腎がん細胞は、腫瘍内在性炎症<好中球を活性化<肺に転移
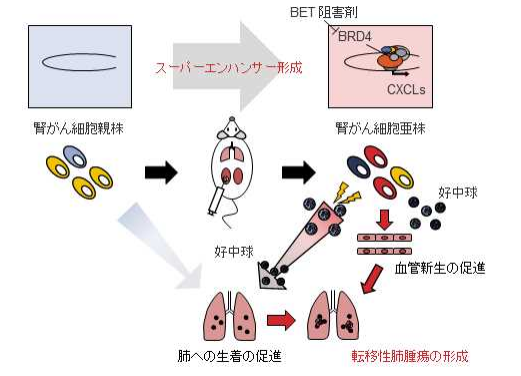
研究では、ヒト腎がん細胞(親株)をマウスの腎臓に移植する腎同所性移植法を用いて、がん微小環境に十分曝露された新しい腎がん細胞(亜株)を樹立し、その形質を解析することで新しい治療標的の探索を行った。樹立した亜株を改めてマウスに移植すると、親株より早く腎臓のがんをつくり、さらに肺に転移したことから、この亜株は進行腎がんのモデル細胞となることが確認された。興味深いことに、亜株で形成された原発腫瘍や肺転移の組織を観察すると、白血球の中でも好中球が多く浸潤していたことから、亜株は腫瘍内在性炎症を誘発する形質を有していることがわかった。
次に、この腫瘍内在性炎症が腎がんの進展の鍵を握ると予想し、好中球数を減少させる抗体を用いた実験を行った。その結果、亜株は好中球に依存して肺に転移することがわかった。またそのメカニズムとして、腫瘍内在性炎症によって活性化した好中球が、新しく血管をつくる作用、がん細胞の肺への生着を促進させる作用など、転移の成立に重要なプロセスに深く関与していることもわかった。一方で、この腫瘍内在性炎症を誘発する形質は亜株に特有のものであり、親株では認められなかったことから、この形質の獲得にあたって、がん微小環境が重要な役割を担っていることが確認された。
続いて、亜株と親株の遺伝子発現を比較し、腫瘍内在性炎症を誘発している制御因子を探索。次世代シーケンサーを用いた解析から、亜株ではCXCL1、CXCL2、CXCL5、CXCL8といった好中球の動態を制御する複数のケモカインの発現が同時に上昇していることがわかった。また、これらの遺伝子のゲノム領域近傍には、スーパーエンハンサーとよばれる特徴的な遺伝子制御領域が形成されていることが観察された。こうしたエピゲノム制御機構が亜株による腫瘍内在性炎症の誘発に重要であると予想されたことから、実際の臨床症例を調べた。すると、上記の複数のケモカインが同時に高発現している症例が、低発現症例や単一発現症例と比較して予後不良であることがわかった。
上記のスーパーエンハンサー領域には、アセチル化ヒストンのリーダータンパクであるブロモドメインタンパク質の高度な結合が見られた。そこで、このタンパク質を標的とするBET阻害剤を用いて治療効果を検証。亜株にBET阻害剤JQ1を加えたところ、CXCL1、CXCL2、CXCL5、CXCL8 の遺伝子発現が一様に低下することがわかった。さらに、亜株を移植したマウスに対して、BET阻害剤による治療を試みたところ、原発腫瘍中に存在する好中球および新生血管が減少し、さらに肺転移が抑制されることが確認された。
「本研究で新たな腎がんの治療標的分子が同定された。BET阻害剤を免疫チェックポイント阻害剤など他の分子標的治療薬と併用することで、相加相乗的な治療効果も期待される」と、研究グループは述べている。
▼関連リンク
・東京大学 広報・プレスリリース最新情報




