独自開発の「iMPAQTシステム」でがん細胞に発現する代謝酵素量を比較解析
九州大学は3月18日、次世代プロテオミクス技術である「iMPAQTシステム」を駆使したがん代謝解析から、悪性のがんではグルタミン由来の窒素をDNAの合成に利用するための代謝系が亢進していること(窒素シフト)を明らかにしたと発表した。これは、同大生体防御医学研究所の中山敬一主幹教授、医学系学府博士課程4年の小玉学大学院生と新潟大学大学院医歯学総合研究科の松本雅記教授らの研究グループによるもの。研究成果は、英国科学雑誌「Nature Communications」で公開されている。
画像はリリースより
炭素と窒素は、生体の主要な構成要素である。細胞は炭素源としてグルコースを、窒素源としてグルタミンを必須の栄養素として取り込んでいる。特にがん細胞では、炭素源であるグルコースの嫌気性代謝に対し強い依存性を示すことが約100年も前から知られており、この現象は発見者の名前に因んで「ワールブルグ効果」(炭素シフト)と呼ばれてきた。一方で、がん細胞は窒素源としてのグルタミンにも非常に強い依存性を示すが、がん細胞がグルタミンの窒素をどのように代謝し利用しているのかは長い間不明であった。
研究グループが独自で開発した「iMPAQT (in vitro proteome-assisted MRM for Protein Absolute QuanTification)システム」は、ヒト細胞に発現する約1万8,000種類のタンパク質の絶対定量を可能とした質量分析システム。これにより、がん細胞に発現する約1,200種の全代謝酵素の定量ができる。研究グループは、同システムを用いてがん悪性化におけるグルタミン窒素代謝機構の解明するため、発がん初期段階の前がん細胞と、悪性化したがん細胞における代謝酵素の発現量比較解析を行った。
悪性化したがん細胞で「PPAT」高発現を確認、「GLS1」が顕著に低下
その結果、悪性化したがん細胞では、解糖系代謝酵素の発現上昇が確認され、ワールブルグ効果が亢進していることがわかった。それに加え、悪性化したがん細胞では、DNAを合成する代謝酵素群の発現が上昇しており、その中でも、グルタミンの窒素を核酸前駆体に転移させる「ホスホリボシルピロフォスファテートアミドトランスフェラーゼ」(以下、PPAT)という代謝酵素の発現量が著明に増加していた。逆に、グルタミンの窒素をアンモニアにして体外に排出する作用を持つ「グルタミナーゼ」(以下、GLS1)という代謝酵素の発現量は、著明に低下していることがわかった。これらの結果から、悪性化したがん細胞では、増殖に必須なDNAを効率的に合成するため、PPATによりグルタミン窒素をDNA前駆体に転移させる反応を亢進させる一方で、グルタミンの窒素を利用せずに体外に排出するGLS1の反応を抑えるという、大きな窒素代謝シフトが生じていることが判明した。
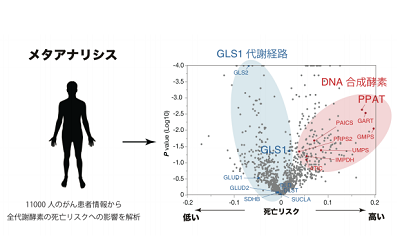
次に、この悪性化したがん細胞におけるグルタミンの窒素代謝シフトが、実際のがん患者の予後にも反映される普遍的な現象であるか証明するため、公共データベースに登録されている1万1,000人のがん患者データを統合解析するメタアナリシスを実施。その結果、PPATが約1,200種の代謝酵素の中でも、最もがん患者の死亡リスクを高める因子であることが明らかになった。反対に、GLS1を介したグルタミン代謝経路に属する代謝酵素の全てが死亡リスクを低める因子であることもわかった。この結果から、グルタミンの窒素代謝シフトが、がんの悪性化に必須であり、かつ普遍的な現象であることが明確になった。
小細胞肺がん患者でPPAT高発現を確認、PPAT阻害剤の開発に期待
この傾向は、難治性であり効果的治療法が確立されていない「小細胞肺がん」において、最も顕著に認められた。小細胞肺がん患者では、正常組織よりもがん部位でPPATの発現量が著明に上昇していること、また、がん部位のPPAT発現量が高いほど、死亡リスクが高くなることも確認された。動物モデルを用いて、小細胞肺がんをはじめとした多くのがん種のPPAT発現量を人工的に低下させた実験を行ったところ、グルタミンの窒素代謝シフトが阻害され、それらがん細胞の増殖能や腫瘍形成能を著明に抑制できることが明らかとなった。
現在、本研究グループは、大規模なPPAT阻害剤の探索を行っている。「今後PPAT阻害剤が開発されることにより、小細胞肺がんを代表とした難治性がんに対する新規治療法の確立が期待される」と、研究グループは述べている。
▼関連リンク
・九州大学 研究成果



