世界的感染拡大の中で、ドラッグリポジショニングは治療薬探しに有効
東京大学医科学研究所は3月18日、新型コロナウイルス感染症(COVID-19)の原因ウイルスSARS-CoV-2の感染の最初の段階であるウイルス外膜と、感染する細胞の細胞膜との融合を阻止することで、ウイルスの侵入過程を効率的に阻止する可能性がある薬剤としてナファモスタット(Nafamostat mesylate、商品名:フサン)を同定したと発表した。この発表は、同研究所アジア感染症研究拠点の井上純一郎北京拠点長(分子発癌分野教授)、山本瑞生助教、合田仁特任講師、松田善衛特任教授、川口寧拠点長(ウイルス病態制御分野教授)によるもの。
画像はリリースより
新型コロナウイルス(SARS-CoV-2)が原因となる感染症(COVID-19)は、2019年暮れに中国・武漢で世界初の患者が確認されてから、2か月あまりで世界152か国に拡散し、世界保健機構(WHO)も2020年3月11日にパンデミックを宣言した。日本では、感染者の多くが無症候性キャリアもしくは軽症であるものの、重症化しさらに高齢者や基礎疾患がある人の場合には死に至ることがある。しかし、現時点で効果が確認された治療薬は存在せず、その開発は急務だ。すでに全世界的にSARS-CoV-2の感染が拡大している現状を鑑みると、安全性が確認された既存の薬から治療薬を探す、いわゆる「ドラッグリポジショニング」は極めて有効と考えられる。
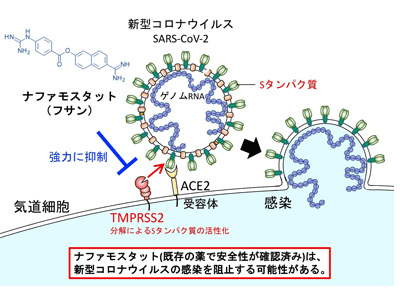
SARS-CoV-2などのコロナウイルスは、脂質二重層と外膜タンパク質からなるエンベロープ(外膜)でウイルスゲノムRNAが囲まれている。SARS-CoV-2はエンベロープに存在するSpikeタンパク質(Sタンパク質)が細胞膜の受容体(ACE2受容体)に結合したあと、ヒトの細胞への侵入を開始する。Sタンパク質はFurinと想定されるヒト細胞由来のプロテアーゼ(タンパク質分解酵素)によりS1とS2に切断される。その後S1が受容体であるACE2受容体に結合する。もう一方の断片S2はヒト細胞表面のセリンプロテアーゼであるTMPRSS2で切断され、その結果膜融合が進行する。Hoffmannらにより、SARS-CoV-2の感染にはACE2とTMPRSS2が気道細胞において必須であることが発表されている。
ナファモスタットがウイルス侵入阻止に有効、カモスタットの10分の1濃度で
井上氏らは2016年に、MERS-CoV Sタンパク質、受容体CD26、TMPRSS2に依存した膜融合系を用いてセリンプロテアーゼ阻害剤であるナファモスタットが膜融合を効率よく抑制してMERS-CoVの感染阻害剤になることを提唱した。そこで今回、293FT細胞(ヒト胎児腎臓由来細胞)を用いてSARS-CoV-2 Sタンパク質、受容体ACE2、TMPRSS2に依存した膜融合測定系を用いて、ナファモスタットがSARS-CoV-2 Sタンパク質による膜融合を抑制するかどうかを検討した。その結果、ナファモスタットは10~1,000nMの濃度域で濃度依存的に膜融合を抑制した。次に、ACE2やTMPRSS2を内在的に発現し、ヒトで感染が起こる際に重要な感染細胞と考えられる気道上皮細胞由来のCalu-3細胞用いて同様の実験を行ったところ、さらに低濃度の1~10nMで顕著に膜融合を抑制した。この濃度域はMERS-CoV Sタンパク質による膜融合に対する抑制濃度域とほぼ同じだ。さらに、ナファモスタットと類似のタンパク質分解阻害剤であるカモスタットの作用を比較検討したところ、SARS-CoV-2 Sタンパク質による融合において、ナファモスタットはカモスタットのおよそ10分の1の濃度で阻害効果を示すことが明らかになった。
これらのことから、臨床的に用いられているタンパク質分解阻害剤の中ではナファモスタットが最も強力であり、COVID-19に有効であると期待される。ナファモスタット、カモスタットともに膵炎などの治療薬剤として日本で開発され、すでに国内で長年にわたって処方されてきた薬剤だ。ナファモスタットは臨床では点滴静注で投与されるが、投与後の血中濃度は今回の実験で得られたSARS-CoV-2 Sタンパク質の膜融合を阻害する濃度を超えることが推測され、臨床的にウイルスのヒト細胞内への侵入を抑えることが期待される。カモスタットは経口剤であり、内服後の血中濃度はナファモスタットに劣ると思われるが、他の新型コロナウイルス薬剤と併用することで効果が期待できる可能性があると、研究グループはみている。
なお、同研究の成果は現時点では未発表である。
▼関連リンク
・東京大学医科学研究所 プレスリリース



