がん細胞は、低酸素環境下で悪性度が高まる
広島大学は3月12日、低酸素環境において活性化し、がん細胞の遊走・浸潤を促進、放射線抵抗性を促進する分子「GLIS1」を発見したと発表した。これは、同大原爆放射線医科学研究所放射線災害医療開発研究分野の島本和美大学院生、谷本圭司講師、廣橋伸之教授、情報・システム研究機構データサイエンス共同利用基盤施設ライフサイエンス統合データベースセンターの坊農秀雅特任准教授、小野浩雅特任助教、順天堂大学大学院江口英孝准教授らの研究グループによるもの。研究成果は、英国のオックスフォード大学出版局科学誌「Carcinogenesis」に掲載されている。
画像はリリースより
高山病に代表される環境中の酸素低下のみならず、貧血、心臓や血管(循環器)の疾患、肺の疾患、糖尿病、がんなどで、酸素供給不足による組織中の低酸素化が疾患発症や増悪と関係することもわかってきている。低酸素環境下のがん細胞は、劣悪な環境を生き延びる手段として低酸素応答性転写因子などを悪用し、より悪性度の高い(治療が効きにくい、浸潤・転移しやすい)がんに変化することが知られている。また、固形がんの中でも乳がんは、ホルモン療法や新しい分子標的治療法が有効な、近年飛躍的に予後が改善しているがんであるが、ホルモン療法や分子標的薬が効かない進行乳がんは、未だ有効な治療法が確立されておらず、治療法開発に向けて、多くの研究が進められている。
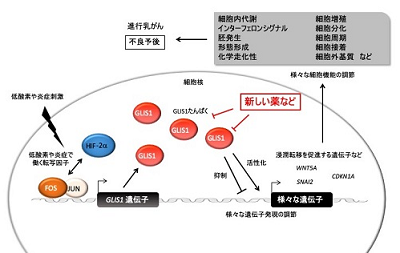
低酸素に対する生体反応の研究は、1995年に低酸素応答性転写因子「HIF-1」が発見されたことにより劇的に前進。これら一連の低酸素応答機構の研究は、生命の酸素利用機構の解明に貢献したとして、2019年のノーベル医学賞を受賞した。研究グループは、1998年から継続的に低酸素応答機構の解明研究に取り組んできており、2013年には、本研究につながる研究として、「GLIS1」遺伝子が低酸素環境で増加することや、その詳細な機構を解明して発表した。また、低酸素環境下ではどのような遺伝子発現量が増加し、どのような遺伝子の発現量が減少するのか、それらは細胞の中でどのような働きをしているのか、さまざまな手法を用いて研究を進めてきた。
細胞レベルでGLIS1はがん細胞の浸潤促進、人工的に抑制すると浸潤低下
研究グループは今回、低酸素環境下で増加したGLIS1が、がん細胞中でどのような働きをしているかについて、遺伝子レベルで人工的に増減して調べた。その結果、GLIS1は、がん細胞の増殖を少し遅くする働きがあるようだったが、明らかに、がん細胞の運動性や浸潤性を促進した。さらに、GLIS1を人工的に増やしたがん細胞では、浸潤に関わる遺伝子「WNT5A」や、放射線応答に関わる遺伝子「CDKN1A」の発現量が増加し、細胞の浸潤能力を高めたり、放射線を照射しても死ににくくなったりしていることが確認された。一方、GLIS1を人工的に抑制すると、浸潤能力が低下することも明らかになり、GLIS1の人工的な機能調節が治療に結びつく可能性を示した。
データ解析により、ホルモン受容体を持たない進行乳がん患者はGLIS1高発現と判明
遺伝子発現データベースとがん患者予後の解析ウェブツール「Kaplan-Meier Plotter」により、乳がん患者全体やホルモン受容体を持つ乳がん患者でその差は見られない一方で、ホルモン受容体を持たない進行乳がん患者においてはGLIS1発現量の高く、がん患者の予後が明らかに悪い(生存期間が短い)ことが明らかとなった。さらに、正常組織における遺伝子発現の大規模測定データベースの比較ウェブツール「RefEx」によって、低酸素環境で働く他の転写因子HIF-1などに比べて、GLIS1は特に正常細胞における発現量が少ないことが明らかとなり、副作用の少ない(GLIS1の人工的な抑制を行なっても正常細胞に影響が少ない)がん治療標的となり得る可能性が示された。
今回、低酸素環境下の乳がん細胞においてGLIS1が、浸潤・転移や、放射線などの治療抵抗性獲得に関わり、特に進行乳がんにおいて、治療標的となり得るという結果を得た。「今後、GLIS1機能(量)を人工的に抑制する方法(核酸医薬、既存・新規の薬や化合物)の開発や、さらなるGLIS1機能の詳細を明らかにすることにより、GLIS1を人工的に抑制したときの副反応の予測が可能となる」と、研究グループは述べている。
▼関連リンク
・広島大学 研究成果



