遺伝子変異によって病態の重症度が異なるが、変異と病態との相関が不明
熊本大学は3月10日、遺伝性の腎臓疾患の一つ「アルポート症候群」の原因遺伝子「4型コラーゲン」の遺伝子型から、病気の重症度を予測するシステムの構築に成功したと発表した。これは、同大大学院生命科学研究部(薬学系)、遺伝子機能応用学研究室の甲斐広文教授らと、神戸大学大学院医学研究科内科系講座小児科の共同研究によるもの。研究成果は、「Kidney International Reports」に掲載されている。
画像はリリースより
近年のゲノム解析技術の目覚ましい進歩により、疾患関連遺伝子の網羅的解析が可能となり、遺伝子情報に基づいた「プレシジョン・メディシン」(精密医療、遺伝子型に応じた治療方針)を模索する機運は、さまざまな疾患で高まっている。遺伝性腎疾患の分野においても、大規模な遺伝子解析が普及し、原因遺伝子変異の同定による正確な診断と新たな疾患分類が精力的に行われている。
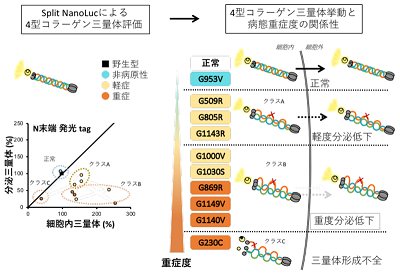
アルポート症候群は、腎臓における尿の濾過機構を担う糸球体に存在する基底膜の構成因子である4型コラーゲンの遺伝子異常により、糸球体濾過機能の異常と、それに伴う慢性的な腎臓の機能の低下を引き起こす。最終的には人工透析もしくは腎移植なしでは末期腎不全に陥り死に至る重篤な疾患で、日本でも難病に指定されている。4型コラーゲンは、α3、α4、α5の3本のポリペプチド鎖(棒状のタンパク質)が複合体(三量体)を形成するが、3本のいずれかに遺伝子変異が生じると、そこから産生されるポリペプチド鎖に異常が生じ、形成不全が引き起こされる。同遺伝子の変異は、これまでに数百種類報告されており、変異によって病態の重症度が異なることがわかっている。しかし、4型コラーゲンの三量体形成能と腎病態の重症度の相関が不明であり、遺伝子変異の種類から、どの程度の腎病態を発症するかを予測することは困難だった。
4型コラーゲンの細胞内形成能、細胞外分泌能により、大部分の重症度は規定できると判明
甲斐教授らは以前、Split NanoLuciferase(split NanoLuc(R))による細胞ベースの4型コラーゲン三量体の異常を高感度で検出するシステムを確立している。同システムは、分割された大小2つのルシフェラーゼ分子(生物由来の発光分子)の断片をそれぞれ4型コラーゲンα3、α5鎖と融合し、α4鎖と共に細胞に発現させると、α3、α4、α5鎖が三量体を形成できる条件でのみ、化学発光が検出されることに着目した評価系。この評価系を活用し、病態重症度の異なる4型コラーゲンα5遺伝子の9変異(重症: G230C、G869R、G1140V、G1149V; 軽症: G509R、G805R、G1000V、G1030S、G1143S)と非病原性と思われる1変異 (G953V)について、細胞内形成三量体および細胞外分泌三量体の評価を行った。
その結果、重症変異は、4型コラーゲンの細胞内形成三量体または細胞外分泌三量体の形成機能と働きが著しく低下したのに対し、軽症変異のほとんどは、細胞外分泌三量体のわずかな低下に留まっていました。したがって、腎症の重症度の大部分は、4型コラーゲン三量体の細胞内形成能および細胞外分泌能により規定されることが明らかになった。一方、非病原性と思われる変異(G953V)コラーゲンでは、三量体の変化がみられなかったことから、本評価系を用いた非病原性・病原性の区別が可能であると考えられました。以上の結果より、Split NanoLuc(R)による4型コラーゲン三量体評価系が、病態重症度の解釈や病原性変異の同定に重要なエビデンスを提供しうることが判明した。
「今回の発見により、4型コラーゲンの遺伝子変異情報のみで、腎症の重症度を予測できるようになり、アルポート症候群のみならず遺伝性難病のプレシジョン・メディシンの推進に貢献することが期待される」と、研究グループは述べている。
▼関連リンク
・熊本大学 プレスリリース



