コケイン症候群は、転写と共役したDNA修復機構(TCR)異常で発症
日本医療研究開発機構(AMED)は3月6日、遺伝子の転写中に生じたDNAの傷を効率よく修復するためには、RNA合成酵素が特定の目印で標識されること(ユビキチン化修飾)が重要であることを明らかにしたと発表した。この研究は、名古屋大学環境医学研究所発生遺伝分野の荻朋男教授、中沢由華助教らの研究グループによるもの。研究成果は、米国科学雑誌「Cell」のオンライン版に掲載されている。
画像はリリースより
生物の遺伝情報を格納したゲノム(DNA)は、生体内の代謝産物のほか外来の放射線や化学物質など、さまざまな要因により常に損傷している。このため、ゲノムを安定に維持・伝達するには、「DNA修復機構」による速やかな損傷の除去が必要だ。ヒトでは、遺伝情報の不安定化は、発がんや老化に伴う諸症状の原因になるほか、生まれながらにDNA修復機能が正常に働かないために、奇形などの各種の発育異常や、神経症状、早期老化、その他多様な症状を示す遺伝性疾患(ゲノム不安定性疾患)も存在する。
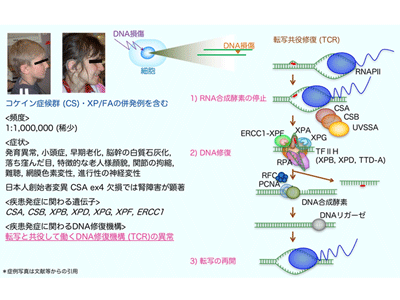
DNAに生じた傷は、遺伝情報を読み出して利用する際にもトラブルを起こす。遺伝情報はDNAから必要な領域がRNAにコピーされ(転写)、タンパク質へと翻訳される。細胞の種類や時期により、必要とされるタンパク質の種類や量が異なるため、転写は厳密に制御される必要がある。遺伝子の転写は2型RNA合成酵素(RNAPⅡ)が行うが、転写中のDNAに傷があると、RNAPⅡは遺伝情報をコピーすることができずに傷の手前で停止する。そこで、DNAの傷を速やかに除去して転写を再開するメカニズムが、転写と共役したDNA修復機構(transcription-coupled DNA repair: TCR)だ。TCRが上手く機能しないと、DNAに傷があり必要な情報が利用できない場合には、細胞は死んでしまう。
コケイン症候群(Cockayne syndrome: CS)はゲノム不安定性疾患の1つであり、TCRの異常により、小頭症や低身長、進行性の各種の神経症状(難聴、視力障害、歩行障害)、腎不全などを発症する。発症頻度は出生100万人に1名程度の非常にまれな劣性遺伝性疾患だ。疾患の原因になる異常は、日本人の創始者変異が知られているERCC8(CSA)遺伝子と、ERCC6(CSB)遺伝子に多く見つかり、これ以外にもERCC1、ERCC3(XPB)、ERCC2(XPD)、ERCC4(XPF)、ERCC5(XPG)遺伝子の異常により、コケイン症候群とあわせて色素性乾皮症(XP)やファンコニ貧血(FA)など、他のゲノム不安定性疾患を併発する症例が報告されている。
RPB1-K1268のユビキチン化でTCR開始と仮定、RPB1-K1268R細胞で証明
TCRにより転写領域のDNAの傷がどのように直されるのかに関しては、30年ほど前に作動モデルが提唱されたが、これまで、TCRがどのように開始されるのかはわかっていなかった。今回、研究グループは、DNA損傷後にRNAPⅡが別のタンパク質で目印が付けられていることに着目し、この目印(ユビキチン化修飾)によってTCRに必要なさまざまなタンパク質のDNA損傷箇所への集積が開始されるのではと考えた。そこでまず、DNA損傷の処理を行った細胞からRNAPⅡを精製し、目印となるユビキチンがRNAPⅡの何処に結合しているかを精密質量分析法で決定。その結果、RNAPⅡを構成している複数のタンパク質のうち、最大のサブユニットであるRPB1の1,268番目のリジン(Lys: K)残基(RPB1-K1268)がユビキチン化されることがわかった。
ゲノム編集法により、RPB1-K1268をアルギニン(Arg: R)に置換させた細胞を作製し(RPB1-K1268R)、DNA損傷の処理後にRNAPⅡのユビキチン化修飾の有無を確認したところ、予想通りRPB1-K1268Rの細胞ではユビキチン化したRNAPⅡがなくなった。また、DNA損傷の処理を行った野生型の細胞とRPB1-K1268R細胞からRNAPⅡを精製し、これに結合するDNA修復タンパク質を確認したところ、RNAPⅡのユビキチン化修飾に依存して、DNA修復タンパク質の複合体であるTFIIHが集積することがわかった。RNAPⅡへのTFIIHの集積には、研究グループが以前に別の遺伝性疾患の原因因子として同定したUVSSAタンパク質も関与している。
DNA損傷が生じた際に、RNAPⅡのユビキチン化修飾がさまざまな遺伝子の転写の回復にどのように寄与しているかを調査するため、今回、DNA損傷とRNAPⅡの局在を定量する新しい技術を開発。細胞からRNAPⅡを精製する際に、RNAPⅡに結合したDNAの断片を回収し、次世代ゲノム解析に用いられる手法で網羅的に塩基配列の解析を実施(ChIPseq法)。DNA損傷の処理後にRNAPⅡを回収すると、RNAPⅡの多くはDNAの傷の手前で停止するため、回収されたDNA断片の片方の鎖には傷が残っている。この傷は塩基配列の解析の妨げになり、DNA断片を遺伝子配列に位置付けた際に偏りとなって現れる(strand-specificity)。この偏りは、RNAPⅡが転写をしている鎖とその反対側の鎖の割合を示しており、DNAの傷がない時には偏りが無く、DNAの傷が多く残っているとより大きな偏りとして現れる(strand-specific ChIPseq法)。本法により、全遺伝子領域でのDNA損傷とRNAPⅡの局在の定量が可能となり、RNAPⅡのユビキチン化修飾ができない細胞では、活発に転写されている多くの遺伝子でDNA修復の速度が遅くなっていることが明らかになった。
Polr2a-K1268Rマウスはコケイン症候群の病態を示した
RNAPⅡのユビキチン化修飾ができない細胞では、上記のようにTCR反応が開始できないため、DNAの傷が修復できない状態が長時間持続する。そこで、今回明らかにされたRPB1-K1268のユビキチン化の異常が、コケイン症候群の病態と密接に関わっていることを証明するために、RPB1-K1268をRに改変した遺伝子改変マウス(Polr2a-K1268R)を作製した。Polr2a-K1268Rホモ接合マウスは、内在性のDNA損傷が多く発生する遺伝的背景(本研究では色素性乾皮症モデルとなるXpa-/-マウスを使用)では、TCRの異常のため長時間の転写障害が生じていると考えられる。このマウス(Polr2a-K1268Rホモ接合/Xpa-/-二重変異マウス)は、他のマウスと比べて生後より体のサイズが非常に小さく、寿命が極端に短い早老症の病態を示した。また、ヒトのコケイン症候群で見られるような、白内障や骨格の異常も観察され、特に、運動ニューロンの劣化が顕著に見られた。これらのことから、RNAPⅡのユビキチン化修飾、特にRPB1-K1268の修飾は、TCR反応の開始に必須であり、この反応が障害されることでコケイン症候群が発症していることが示された。研究グループは、このモデルマウスについて、「転写に関する基礎研究のほか、老化に関連するさまざまなヒト疾患の病態解明や、治療薬の開発に有益なツールとなることが期待される」と、述べている。
▼関連リンク
・日本医療研究開発機構 プレスリリース




