心血管疾患は日本の主要な死因、その原因として動脈硬化が重要
東京大学アイソトープ総合センターは3月4日、動脈硬化におけるエピジェネティックな転写抑制機構の破綻とそれに引き続く炎症性遺伝子活性化のメカニズムを明らかにしたと発表した。この研究は、東京医科歯科大学難治疾患研究所の東島佳毅研究員、東京大学アイソトープ総合センターの神吉康晴助教らが、東京大学医学部附属病院腎臓・内分泌内科、カリフォルニア大学サンディエゴ校の研究チームらと共同で行ったもの。研究成果は、「The EMBO Journal」にオンライン公開されている。
画像はリリースより
心血管疾患は日本の死因第2位の心疾患と第4位の脳血管疾患を合わせた総称で、その数は第1位の悪性新生物に匹敵する。また、国民医療費においても心血管疾患を含む循環器疾患が1位であり、要介護認定の原疾患の2位を占めていることからも医療経済的に重要な分野となっている。心血管疾患の原因として高血圧や高脂血症に起因する血管内皮細胞の慢性炎症および動脈硬化が重要だ。これまで心血管疾患の治療は、降圧剤や脂質異常症治療薬による血圧および脂質値低下に焦点を当てて行われてきた。特に脳血管疾患においては、降圧剤による血圧管理の徹底によって顕著な死亡率の低下が認められてきた一方で、近年は高血圧の治療率の向上にもかかわらず、一貫して心疾患による死亡率が増加している。最近の大規模臨床研究において、血管炎症の抑制が血圧および高脂血症の改善とは独立したメカニズムで心血管疾患を抑制することが報告され、血管炎症をターゲットとした新しい予防および治療法の確立が期待されている。
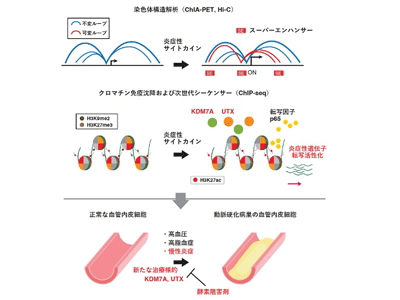
ヒストン修飾などのDNA塩基配列の変化を伴わずに遺伝子の機能および発現を調節する機構「エピジェネティクス」の異常がさまざまな疾患において、その発症や進展に重要であることがわかってきている。動脈硬化発症に重要な炎症性遺伝子は、正常な血管内皮細胞ではほぼ完全に発現が抑制されている。そこで研究グループは、動脈硬化においてエピジェネティックな抑制機構の破綻が血管内皮細胞における炎症性遺伝子の活性化に関与していると仮説を立てて検討を行った。
動脈硬化発症に炎症性遺伝子のエピジェネティックな転写抑制機構の破綻が重要
ヒト血管内皮細胞に炎症性サイトカインを作用させて、ヒストン修飾状態をクロマチン免疫沈降および次世代シーケンサー(ChIP-seq)により網羅的に解析したところ、動脈硬化に重要な多数の炎症性遺伝子座において、抑制系ヒストン修飾であるH3K9me2およびH3K27me3が刺激後速やかに脱メチル化されることが明らかとなった。遺伝子スクリーニングによって、これら抑制系ヒストン修飾の脱メチル化に Lysine demethylase 7A(KDM7A)および6A(UTX)がそれぞれ関与することが判明した。
より詳しい検討を行ったところ、KDM7AおよびUTXが結合するゲノム領域はスーパーエンハンサーと呼ばれる強いエンハンサーと相関していること、さらに染色体構造解析によって、こうしたスーパーエンハンサーの相互作用が炎症性遺伝子の転写活性化に重要であることが明らかとなった。加えて、マウスモデルにおいて、KDM7AおよびUTXの阻害剤投与が動脈硬化初期病巣で頻繁に認められる血管内皮細胞への白血球接着を抑制することが確認された。以上より、血管内皮細胞における炎症性遺伝子の発現誘導にKDM7AおよびUTXによる抑制系ヒストンの脱メチル化が重要である可能性が考えられた。
今回の研究により、血管内皮細胞における炎症性遺伝子のエピジェネティックな抑制機構の破綻という新しい動脈硬化発症メカニズムが明らかとなった。さらにこのメカニズムを標的とした動脈硬化治療の新しい可能性が考えられた。血管炎症は心血管疾患だけでなくがんやアルツハイマー病などさまざまな生活習慣病の発症進展に関与していることから、研究グループは今回の成果を基盤として、今後は血管内皮細胞におけるエピジェネティックな制御機構の破綻の他の病態モデルにおける関与を探索し、この経路をターゲットとした治療法の開発に取り組んで行く予定だとしている。
▼関連リンク
・東京大学アイソトープ総合センター トピックス



