骨軟骨疾患や脊損など多くの治療で注目のBMMSC、細胞老化が課題
近畿大学は2月28日、骨や軟骨損傷の治療、皮膚難病や血管疾患など多くの領域で再生医療に使われている幹細胞の一種である「骨髄間葉系幹細胞」の新しい老化メカニズムを発見したと発表した。この研究は、同大学病院麻酔科の中尾慎一教授、同大学病院高度先端総合医療センター再生医療部の福田寛二部長、寺村岳士講師らの研究グループによるもの。研究成果は、「Scientific Reports」にオンライン掲載されている。
画像はリリースより
現在、ES細胞やiPS細胞など「幹細胞」を用いた再生医療が注目を集めている。幹細胞は「分化」と呼ばれるさまざまな細胞に変化する能力や、傷の治癒、炎症の抑制に効果のあるタンパク質を作り出す能力があることから、これまでに有効な治療方法がなかった難病やけがの治療に有効であると考えられている。
骨髄間葉系幹細胞(Bone Marrow Mesenchymal Stem Cells:BMMSC)はヒトの骨髄に存在し、骨、脂肪、軟骨などに分化することができる組織幹細胞だ。移植後に腫瘍を形成する危険性が非常に低いことから、骨や軟骨損傷の治療、皮膚難病や血管疾患など多くの領域で再生医療の中心として使われている。また最近では、初の細胞医薬品としても実用化されているなど、非常に注目度が高い。一方で、BMMSCは加齢に伴う劣化や、培養による細胞老化などの問題が知られていた。
老化BMMSCでmiR-142高発現、劣化ペルオキシソーム蓄積
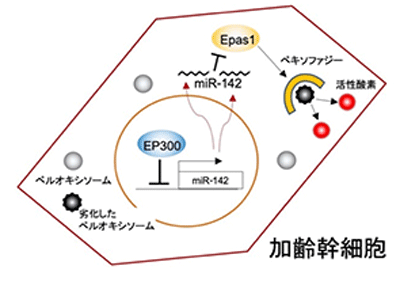
これまでにもBMMSC老化のメカニズムは示されてきたが、今回、研究グループは、新たな老化の仕組みを発見した。研究グループは、老化細胞の重要な特徴である活性酸素の蓄積には、老化で発現するマイクロRNA(miRNA)が関与していると想定し、次世代シーケンサーで老化したBMMSCでのmiRNA発現パターンを解析。その結果、miR-142を発見した。さらに研究を進め、劣化した細胞でみられるペルオキシソームの異常蓄積現象がmiR-142の発現によって引き起こされること、miR-142はペルオキシソームを除去するシステムを阻害していることを明らかにした。
これまでの研究で、老化した細胞では、いくつかの転写因子の発現が抑制されていることがわかっている。そこで、ソフトウェアによるシミュレーション解析を実施したところ、Ep300という転写補酵素の減少が、老化によるmiR-142の発現を引き起こすということが明らかになった。研究グループは、「今回の研究成果により、再生医療に用いるBMMSCの品質検査や、miRNAを制御することで移植細胞の老化を抑制するなど、これまでになかった再生医療技術の開発が期待される」と、述べている。
▼関連リンク
・近畿大学 ニュースリリース



