技術的な問題で明らかにされていなかった血管ネットワークの構造と機能
東京大学は2月27日、マウス全脳血管ネットワークの構造と機能を可視化する手法を開発したと発表した。これは、同大大学院薬学系研究科の宮脇健行大学院生(研究当時)、池谷裕二教授らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
脳は、3次元上に広がる血管ネットワークにより栄養供給を受けている。また、血管と組織中の物質交換は、多様な細胞からなる血液脳関門によって制御されている。そのため、血管ネットワークの構造と機能、それらの周囲組織との関係を記述することは、脳の栄養供給様式の理解に重要であると推察される。しかし、このような研究は技術的な問題から、これまで進んでいなかった。
例えば、薄層切片を用いた古典的な組織学では、血管は切断されるため、その接続関係の情報は失われてしまう。接続関係を調べるためには標本を3Dで観察する必要があるが、血管の3D観察に古くから用いられている血管腐食鋳造法は、微小血管の可視化に優れないことに加え、周囲の分子情報を保存できないという問題を抱えている。その点、組織透明化法は、標本を3D観察できるだけではなく、血管周囲の分子情報を保存できるので、前述の問題を解決することが期待される。しかし、透明化手法は既存の血管染色手法と相性が悪く、周囲分子を保存したまま全脳血管の構造を捉えることは困難だった。
新規の蛍光モノマーと重合法で、細い血管まで高いSN比で染色できる血管鋳造法を確立
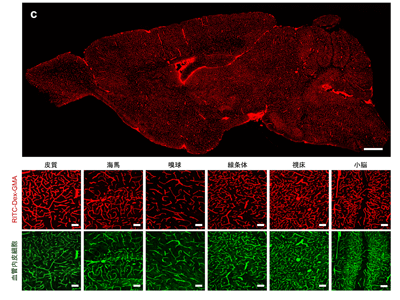
研究グループはまず、血管鋳造法の改良に取り組んだ。従来の血管鋳造法では、重合途中のポリマーを心臓から流し込んでいたため、大きくなっていくポリマーが微小血管で梗塞を起こし、全ての血管を可視化することはできなかった。そこで、未重合のモノマーを全血管に行き渡らせた後に重合を開始すれば、全ての血管が鋳造できるのではないかと考えた。しかし、これを実現するためには「重合の開始を任意のタイミングで制御すること」と「蛍光を持つモノマーが、重合されていない状態でも、血管から漏れ出さない」という条件を満たす必要がある。研究グループは、1つ目の条件を、市販されている温度依存的な重合開始剤を用いることで解消し、2つ目の条件を独自に合成した蛍光モノマー「RITC-Dex-GMA」を開発することでクリアした。
さらに、RITC-Dex-GMAと、同じくモノマーとなるアクリルアミド、温度依存的な重合開始剤である VA-044を低温で心臓から流し込んで全血管に行き渡らせた。そして、灌流したマウスを37℃で3時間温めることによって重合反応を行い、血管を鋳造した。その後、実際にどの程度の血管が染色されているのかを調べるため、標本の切片を作成し、血管内皮細胞マーカーであるCD31で免疫染色を行った。その結果、RITC-Dex-GMAのシグナルは、CD31のシグナルと98.1%という高い共局在率を示し、これは一般的な染色剤であるレクチンによる染色よりも有意に高いことが判明した。また、同手法によって得られるシグナルは、既存のどの手法よりも有意に強いシグナルだった。このように、新規の蛍光モノマーと重合法により、細い血管まで高いSN比で染色できる新規の血管鋳造法を確立した。
次に、この血管鋳造法に最適化された透明化手法の作成を試みた。胆汁酸塩の一つであるデオキシコール酸ナトリウム(SDC)を用いたところ、同じ7日間の脱脂で、白質まで均一に透明になることがわかった。また、SDC処理したサンプルでも10%程度の膨潤が見られるものの、その度合いはSDSで見られた40%程度の膨潤よりも有意に低いものであることがわかった。この緩やかな膨潤が、血管を観察する際に重要な性質だという。今回開発した血管鋳造法を用いたサンプルをSDSで透明化したところ、断裂した血管像が多く得られることが判明。
一方で、SDCで透明化した群ではそのような断裂はほとんど見られなかった。貫入血管の本数を用いて断裂の程度について定量したところ、SDSの群では約80%の血管が断裂していたのに対し、SDC の群では1%未満しか断裂していなかった。このことから、SDCによる透明化は、迅速に透明化ができるだけでなく、血管のつながり方を保存するという点においても優れていることが示された。
SeeNetを適用したマウス脳血管の3Dトレーシングで皮質と海馬をつなぐ新規血管経路を発見
さらに、同手法が血管周囲組織のタンパク質発現等の情報を保持しているかを検討するため、SeeNetによって調製したサンプルについて、核酸の染色剤(Propidium Iodide)、あるいは、マイクログリア、アストロサイト、ニューロンに対する抗体(anti-Iba1, anti-GFAP, antiNeuN)を適用した。その結果、それぞれのシグナルは観察可能であることがわかった。また、GFPやmCherry、Venus等の蛍光タンパク質を発現するマウスに対してSeeNetを適用したところ、これらの蛍光タンパク質の蛍光は保存されていることが明らかになった。このことから、SeeNetは、血管ネットワークの構造のみならず、それぞれの血管が持つ機能的特徴や、その周囲組織との関係を調べるのに有用であることが示唆された。
加えて、同手法の高いSN比で全脳血管を捉えることが可能か検討するために、ライトシート顕微鏡で脳の撮影を実施。その結果、脳深部の白質においても血管のシグナルが捉えられており、脳の最も深い部分においてもシグナルが消失することはなかった。このことから、同手法の高いSN比は、全脳の血管を捉えるために十分であることが示された。これらに加え、同手法の応用例としてSeeNetを適用したマウス脳血管の3D トレーシングを行った結果、皮質と海馬をつなぐ新たな血管経路を発見した。
今回の研究成果により、これまでは手法的な限界からほとんど開拓されてこなかった「脳血管のネットワーク科学」の発展に貢献することが期待される。例えば、「脳血管は効率の良い栄養供給に適したネットワーク構造を有しているのか?」「脳血管の分岐パターンや血液脳関門の多様性はどのようなルールに基づいて制御されているのか?」「病態モデルマウスにおいてそれらに変化はあるのか?」などの問いが、今後さまざまなグループで検討可能になると考えられる。
研究グループは、「このような研究がもたらす知見は、血管から得られる信号を神経活動に相関する指標として用いる、機能的MRIのデータ解釈への応用も予想されるため、基礎的な研究だけでなく、臨床的な研究にも役立つ可能性が考えられる」と、述べている。
▼関連リンク
・東京大学 プレスリリース




