モデルマウスと患者の病態に相違、根本的な病態メカニズムは未解明
愛知医科大学は2月19日、球脊髄性筋萎縮症(Spinal bulbar muscular atrophy:SBMA)の患者由来のiPS細胞および疾患モデルを作成、解析の結果、神経変性にシナプスの病態が深く関与することを見出したと発表した。これは、同大医学部内科学講座(神経内科)の岡田洋平准教授、小野寺一成研究員(名古屋大学大学院医学系研究科神経内科学客員研究者)らの研究グループが、慶應義塾大学医学部、名古屋大学大学院医学系研究科、新潟大学大学院医歯学総合研究科、東京医科歯科大学、東京大学と共同で行った研究によるもの。研究成果は、英国科学誌「Molecular Brain」にオンライン掲載されている。
画像はリリースより
SBMAは、成人で発症し、緩やかな進行を示す難治性の運動神経変性疾患で、根治療法がないとされる難病。アンドロゲン受容体(AR)遺伝子のCAG反復配列の伸長(変異AR)が原因で発症することが明らかになっており、これまでのモデルマウスや細胞モデルを用いた研究により、ARのリガンドであるテストステロンに依存して変異ARが凝集体を形成し、運動神経を変性させることが示されてきた。しかし、モデルマウスと実際の患者の病態には相違があり、根本的な病態メカニズムは未だ解明されていない。正確な病態の解析・治療法の開発のためには、より正確にSBMA患者の病態を反映する疾患モデルが必要である一方、ヒト由来の運動神経を採取することは困難とされている。
SBMA運動神経で神経筋接合部形成に重要なシナプス関連の遺伝子群の発現上昇
研究グループは、まずSBMAの患者の皮膚線維芽細胞からiPS細胞を樹立。原因となるARのCAG反復配列数はiPS細胞の樹立(リプログラミング)の過程で変化はなかった。次に、iPS細胞を運動神経へ分化誘導し、4週間の成熟培養を行った。解析する運動神経の純度を上げるために、運動神経を蛍光タンパクにより特異的に標識し(HB9e438::Venus)、フローサイトメトリーにより分取したところ、高純度の運動神経を得ることに成功。このように濃縮された運動神経では、iPS細胞株間の誘導効率の不均一さが改善していた。
また、分取した運動神経からRNAを抽出して、RNAシークエンス解析を行い、健常者と比較してSBMAで変化している遺伝子群を探索。遺伝子オントロジー解析、パスウェイ解析では、SBMAの運動神経でシナプス、神経伝達物質、エキソサイトーシス、エピジェネティクス関連カテゴリーの遺伝子群が高発現していたことが明らかになった。また、小胞体カテゴリーの遺伝子群の発現低下も認められた。
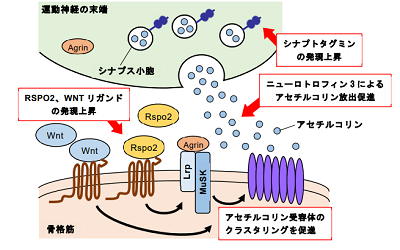
特に、シナプス関連遺伝子群の中には、神経筋接合部(Neuromuscular junction:NMJ)の形成に必要不可欠なアセチルコリン受容体のクラスタリングを促すRSPO2遺伝子やWNTリガンド遺伝子の発現上昇、またNMJの形成を抑制的に制御するWNT3A遺伝子の発現上昇がみられ、NMJ形成異常の原因となっている可能性が示唆された。
今回の研究成果から、SBMAの運動神経変性にシナプスの病態が深く関わることが明らかになった。モデルマウスではNMJの変性が示されているが、今回初めてSBMA患者iPS細胞由来運動神経におけるシナプス関連遺伝子の発現異常が示された。こういった遺伝子の変動がSBMAの病態を理解する手がかりとなり、NMJを標的とした病気の進行を抑制する治療開発が期待される。
▼関連リンク
・愛知医科大学 ニュース



