指定難病22q11.2欠失症候群、TBX1以外にも原因遺伝子が存在
大阪大学蛋白質研究所は2月12日、指定難病のひとつで重篤な先天性障害をきたす22q11.2欠失症候群に糖代謝制御異常が関与する可能性を発見したと発表した。この研究は、同研究所細胞システム研究室の岡田眞里子教授(兼:医薬基盤・健康・栄養研究所(NIBIOHN)細胞ネットワーク制御プロジェクト・プロジェクトリーダー、理化学研究所 生命医科学研究センター統合細胞システム研究チーム・チームリーダー)、米シカゴ大学ベン・メイがん研究所のAkira Imamoto准教授、理化学研究所生命医科学研究センター統合細胞システム研究チームの奇世媛テクニカルスタッフ(旧所属)、慶應義塾大学先端生命科学研究所の福田真嗣特任教授、東京大学大学院新領域創成科学研究科の鈴木穣教授、東京工業大学生命理工学院らの国際共同研究グループによるもの。研究成果は、国際科学誌「Life Science Alliance」に掲載されている。
画像はリリースより
指定難病のひとつである22q11.2欠失症候群は、ヒト染色体22番q11.2の一部欠損により、心疾患、免疫不全、腎泌尿器疾患などのさまざまな重篤な先天性障害をきたすことが報告されている。この疾患は、染色体の微小欠失から起こる症候群としては最も頻度が高く、最近の推定では、1,000胎児当たり約1個体の頻度で発見され、新生児では 3,000~6,000個体のうち1人の頻度とされている。これまでの研究より、22q11.2欠失染色体領域に存在する遺伝子のうちTBX1が発症に最も重要な疾患候補遺伝子として考えられてきたが、染色体欠失領域がTBX1を含まない患者も多く存在し、また、症候群としての重篤度なども個体差が非常に大きいため、複雑な発症機序がかかわっていることが予想されていた。
CRKLおよびCRK遺伝子ファミリーの欠損による中心糖代謝系低下が関与の可能性
今回の研究で注目したCRKおよびCRKL遺伝子は、ともに、シグナル伝達系と呼ばれる環境と細胞内の遺伝子調節や代謝などを制御する生化学反応を司るタンパク質をコードし、細胞増殖、形態制御、代謝、免疫応答など、さまざまな疾患との関係が報告されている。これまでに、シカゴ大のImamotoらは、マウスモデルで実験を行い、CRKLが22q11.2欠失症候群の候補遺伝子であり、CRKLの欠失が胎生期に心血管形成を含む神経堤細胞由来の臓器の異常を引き起こすことを報告した。また、22q11.2欠失症候群の症状のうちの、少なくとも、腎泌尿器疾患にはTBX1ではなくCRKLが関与する可能性が高いことがImamotoらを含む多数の研究室の共同研究により報告されている。
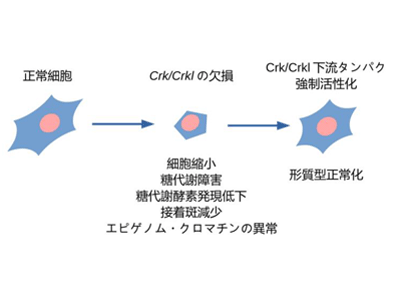
今回、研究グループは、マウスの遺伝子交配実験により、22q11.2欠失症候群の原因遺伝子候補の1つであるCRKLとその同じ遺伝子ファミリーに属するCRKの欠損がそれぞれ、22q11.2欠失症候群のもう1つの原因遺伝子候補として知られるTBX1の欠損と同時に起こることにより、より重篤なマウスの心形成異常が引き起こされることを明らかにした。また、CRKは染色体22q11上の遺伝子ではないにもかかわらず、CRKLまたはCRKのそれぞれの遺伝子単独のホモ欠損、CRK/CRKLの共ヘテロ欠損をマウスに引き起こすと、22q11.2欠失症候群に似た形態異常を示した。このことから、CRKLとCRKの機能の共通部分が、この症候群で異常の起きる胎生期の発生過程に重要であることが示唆された。CRKおよびCRKLは、ともに、シグナル伝達系を司ることから、この遺伝子欠損マウスから得た細胞を使い、全遺伝子発現プロファイリング、エピゲノム、メタボローム解析などを含めた、多種類のオミクス解析によるデータ駆動型研究の手法を用いて、この2つのタンパク質の機能の共通部分を探索。その結果、中心糖代謝系の低下といった異常が見られることを発見した。
さらに、糖代謝の抑制薬剤が、CRK/CRKL欠損細胞の生存率を悪化させること、また、それとは逆に、CRK/CRKL制御下のタンパク質を活性化させることにより、糖代謝障害を含む CRK/CRKL 欠損細胞の形態を回復できたことから、22q11.2欠失症候群の発症機序の少なくとも一部は、中心糖代謝障害によるものと推測された。今回の成果について研究グループは、「胎生期の栄養などのコントロールにより、糖代謝制御の改善を通した、22q11.2欠失症候群の新しい治療法の開発につながることが期待される」と、述べている。
▼関連リンク
・大阪大学蛋白質研究所 最新研究成果



