「主細胞<化生性細胞」という定説は本当に正しいか
東京大学医学部附属病院は2月5日、胃がん発生のメカニズム解明に向けた検証で、独自に作成した新規のマウスモデルを用い、主細胞は胃粘膜障害の過程で脱分化せずに消失し、実際には化生性細胞の起源とはなり得ないことを証明したと発表した。これは同大大学院医学系研究科消化器内科の畑昌宏医師(医学博士課程4年)、同木下裕人助教(研究当時)、早河翼助教、小池和彦教授らの研究グループが岐阜大学・東京理科大学・豪アデレード大学・米コロンビア大学などの協力を得て行ったもの。研究成果は「Gastroenterology」に掲載されている。
これまで、ピロリ菌や薬剤性の胃粘膜障害によって生じる前がん病変である「化生性細胞」は、正常の胃粘膜に存在し消化酵素などを分泌する「主細胞」と呼ばれる特定の細胞群のマーカーを発現していることから、化生性細胞が主細胞から発生している可能性が提唱されていた。さらに、主細胞をタモキシフェン依存的に標識できるマウスモデルによって行われた系譜追跡実験により、主細胞が炎症刺激によって脱分化し、新しい幹細胞のような性質を帯びた細胞へと変化して化生性細胞の起源となることを示した報告が相次いだため、主細胞が前がん病変の主たる起源であるという説が定説となっていた。
しかし、主細胞がなぜ、どのようにして化生性細胞やがんに変化していくかについて、その詳細な時間経過やメカニズムについては不明のままだった。また、過去の系譜追跡実験で用いられた薬剤の「タモキシフェン」がマウスの胃粘膜に高度の障害を引き起こすことや、主細胞を選択的に標識するとされていたマウスが実際には主細胞以外の幹細胞や前駆細胞も標識していることなどがわかり、これまでのタモキシフェンを用いた実験系が本当に正確な細胞動態を反映しているのかについては疑問があった。
ドキシサイクリン依存的マウスモデルを構築、主細胞は胃粘膜障害の過程で脱分化せずに消失
 画像はリリースより
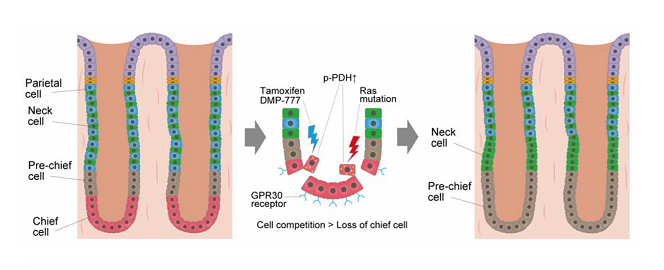
画像はリリースより研究グループは、過去の実験系の弱点を克服するため、全く新しい独自のマウスモデルを開発。まず、網羅的遺伝子発現解析によって主細胞のみに発現する遺伝子「GPR30」を同定した。次に、タモキシフェンを用いずに系譜追跡実験が可能なドキシサイクリン依存的マウスモデルを構築した。この新しいマウスモデルを用いて化生性細胞を生じさせたところ、これまでの予想に反し、主細胞は胃粘膜障害の過程で脱分化せずに消失し、化生性細胞の起源とはならないことが判明した。この過程において、消失した主細胞を補充しようという生体反応によって、もともとの幹細胞や前駆細胞が盛んに細胞増殖を行い、結果として化生性細胞へと変化していることがわかった。
興味深いことに、今回同定した主細胞マーカーのGPR30は、タモキシフェンの受容体でもある。GPR30ノックアウトマウスで検証したところ、タモキシフェンによる胃粘膜障害や化生性変化が抑制されたことから、GPR30受容体が主細胞の消失を制御していることもわかった。具体的には、まずタモキシフェンをはじめとする化生変化惹起刺激がGPR30受容体を介し、GPR30陽性主細胞内のピルビン酸脱水素酵素を活性化する。これにより生じた上皮細胞間の代謝状態の不均衡が、周囲の正常細胞からの細胞競合を惹起し、結果として主細胞が選択的に排出・除去されるというメカニズムが存在することがわかった。これまでのタモキシフェンを用いた系譜追跡実験では、タモキシフェン投与自体がGPR30受容体を介した細胞競合と主細胞の消失を引き起こしていたため、正確な検討ができていなかったと考えられる。
「今回の新しい実験モデルと多くの新しい知見は、当該研究領域に極めて大きな影響を与え、過去の多くの研究の解釈に見直しが必要になると考えられます。しかしながら、胃の前がん病変の真の起源とその発生メカニズムが明らかになったことから、今後の胃がん研究のさらなる発展と新規胃がん治療の開発に結び付くことが期待される」と、研究グループは述べている。
▼関連リンク
・東大病院 プレスリリース



