炎症性サイトカイン発現低下などに寄与する「Nrf2」の活性化による効果を検証
東北大学は1月21日、転写因子「Nrf2」がアルツハイマー病のモデルマウスの病態を改善することを明らかにしたと発表した。これは、同大東北メディカル・メガバンク機構の宇留野晃准教授、同大遺伝子実験センターの松丸大輔助教(現・岐阜薬科大学)、東北メディカル・メガバンク機構の山本雅之教授(機構長兼)らと、同大加齢医学研究所の川島隆太教授らの共同研究によるもの。研究成果は、米国科学雑誌「Molecular and CellularBiology」のオンライン版に掲載されている。
画像はリリースより
日本では高齢化に伴い認知症患者が増加。アルツハイマー病は認知症の主な原因であることから社会的に重要な疾患である。この疾患は、脳内で発生する酸化ストレスや炎症によって病態が悪化する。
Nrf2は、酸化ストレスなどの発生に伴い、ストレスに応答して活性化される転写因子。抗酸化酵素や解毒代謝酵素の遺伝子発現を増加させたり、炎症を引き起こすサイトカイン遺伝子の発現を低下させる働きをし、さまざまなストレスから細胞を保護する役割を果たしている。これまで、Nrf2の活性化が病態改善に寄与すると予測されていたが、アルツハイマー病におけるNrf2活性化の効果は知られていなかった。
Nrf2 活性化アルツハイマー病モデルマウスで酸化ストレス低下
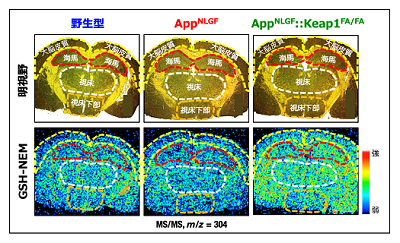
Nrf2は、他の分子から電子を奪う性質の「親電子性分子」により活性化される。このような分子の利用は、Nrf2活性化の効果を解析するためには有用だが、Nrf2以外にも影響を及ぼすことが知られている。これをふまえ、今回の研究では、Nrf2の役割を正確に解析するため、Nrf2を調節している「Keap1」の遺伝子を改変した「Keap1FA/FAマウス」を用いた。同マウスはKeap1の発現量が低く、Keap1がNrf2を抑制する役割を持つことから、Nrf2が活性化された状態になっている。また、アルツハイマー病モデルとしては、理化学研究所脳神経科学研究センターの西道隆臣チームリーダーらにより開発された、アミロイド前駆タンパク質(APP)の遺伝子変異ノックインマウスである 「AppNLGFマウス」を利用。さらに、これらのマウスを組み合わせた 「AppNLGF::Keap1FA/FAマウス」を作製し、野生型とAppNLGFマウスの3モデルを質量分析イメージング解析し、比較検証した。
その結果、アルツハイマー病モデルであるAppNLGFマウスでは、認知機能の障害を認めたが、Nrf2 活性化アルツハイマー病モデルの AppNLGF::Keap1FA/FAマウスでは、認知機能障害が改善していた。AppNLGF::Keap1FA/FAマウスの脳内では、AppNLGFマウスと比べ、抗酸化分子のグルタチオンを合成するための酵素の発現が増加し、炎症性サイトカインが低下していた。また、AppNLGFマウスで、脳内に生じたアミロイド斑の周囲に活性化したミクログリアが集まり炎症が引き起こされ、加えて神経細胞線維の低下を認められた。ところが、AppNLGF::Keap1FA/FAマウスでは、これらの異常が軽減されていた。さらに AppNLGF::Keap1FA/FAマウスでは、脳内の還元型グルタチオンが増加することで、酸化ストレスが低下していることもわかった。
Nrf2 活性化アルツハイマー病モデルマウスで酸化ストレス低下
Nrf2を活性化する親電子性分子として、ワサビに含まれる「6-MSITC」が知られている。そこで、AppNLGFマウスに 6-MSITCを経口投与し、アルツハイマー病への治療効果を検証。すると、同マウスの脳内で、活性化型ミクログリア数を低下していることがわかった。さらに6-MSITCの投与は、AppNLGFマウスにおける認知機能の障害を軽減することが明らかになった。
今回の研究により、Nrf2の活性化が酸化ストレスや炎症を軽減して、アルツハイマー病の病態を改善させることが解明された。「今後はNrf2 を標的とした脳の酸化ストレスや炎症の抑制に基づく、新しい予防法・治療法の開発が可能になるものと期待される」と、研究グループは述べている。
▼関連リンク
・東北大学 プレスリリース



