マクロファージの分化機構に着目した研究
石川県立大学は1月17日、亜鉛欠乏による大腸炎増悪メカニズムを解明したと発表した。これは、同大生物資源環境学部食品生化学研究室准教授 東村泰希および京都府立医科大学大学院医学研究科医療フロンティア展開学(消化器内科学併任)髙木智久准教授、同・消化器内科学 内藤裕二准教授、同・伊藤義人教授らの研究グループによるもの。研究成果は、科学雑誌「Journal of Crohn’s and Colitis」に掲載されている。
画像はリリースより
腸管粘膜にはマクロファージ(Mph)や樹状細胞など多くの自然免疫細胞が存在しており、腸管における免疫応答や蠕動運動などの生理的機能の恒常性を維持する上で重要な役割を果たしている。これらの免疫細胞の異常な活性化が、炎症性腸疾患の発症要因のひとつと考えられている。
Mphは腸管粘膜固有層に最も多く存在する貪食細胞で、腸管炎症の病態形成におけるMphの機能が注目されている。炎症型(M1)と炎症抑制型(M2)に大別されており、炎症病態の形成にはM1型のMphが関与すると考えられている。一方で、M2型Mphの分化誘導は、炎症性腸疾患の抑制に奏功する可能性が示されている。これらの考えを基に研究グループはこれまで、Mphの分化制御と腸管炎症に関する研究を進めており、遺伝子改変マウスや食品由来因子を用いて、MphのM2誘導を基軸とした大腸炎抑制に関する知見を報告してきた。
必須微量元素である亜鉛は、生体の免疫応答に深く関与している。さまざまな炎症病態モデルにおいて亜鉛の重要性が示されているが、腸管炎症と亜鉛に関する知見は未だ不十分だ。一方、これまでの臨床的な知見として、炎症性腸疾患の罹患者、特にクローン病患者の血中亜鉛濃度は、健常者に比べて低値を示すことが知られている。しかし、血中亜鉛濃度の低下に伴う腸管炎症病態への影響に関しては不明な点が多く、その詳細は明らかになっていない。そこで研究グループは、Mph分化機構に焦点を当て、亜鉛欠乏が腸管炎症に及ぼす病態生理的作用に関して明らかにすることを目的とし、研究を行った。
亜鉛欠乏により、IL-23/Th17経路が活性化することが判明
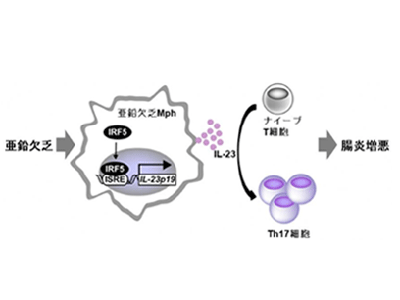
まず、亜鉛欠乏マウスを作製し、同マウスにおいて炎症性腸疾患の実験モデルであるトリニトロベンゼンスルホン酸誘発性大腸炎モデルを作製した。その結果、亜鉛欠乏に伴い大腸炎が著明に増悪することを見出した。その後、フローサイトメーターを用いて作用機序を解析した結果、大腸粘膜固有層において炎症型であるM1型Mphの増加ならびに17型ヘルパーT(Th17)細胞が活性化することが判明した。また、Th17細胞の活性化には、M1型Mphから分泌されるインターロイキン-23(IL-23)が関与することを明らかにした。
次に、マウス骨髄由来単球より分化誘導したマウス骨髄由来マクロファージ(BMDM)を用いて、MphにおけるIL-23発現と、亜鉛欠乏との関係を調べた。その結果、亜鉛キレーターであるTPENの添加により細胞内亜鉛欠乏を呈したBMDMでは、IL-23を構成するサブユニットであるIL-23p19の発現が有意に亢進することを見出した。さらに、亜鉛欠乏に伴うIL-23p19の発現亢進には、インターフェロン応答型転写因子であるIRF5の核内移行ならびにIL-23p19プロモーター上へのリクルートの促進が関与することを明らかにした。
亜鉛を用いた炎症性腸疾患治療につながる可能性
クロ―ン病患者などの炎症性腸疾患患者の血中亜鉛濃度が低値を示すことは古くから知られていたが、腸管炎症におけるその意義についてはこれまで明らかにされていなかった。今回の研究で、亜鉛が欠乏することにより、インターフェロン応答型転写因子IRF5の核内移行に起因したMphのM1分化を介した腸管炎症病態進展機構の一端が解明された。
研究グループは、「亜鉛欠乏によって惹起されるIL-23/Th17経路活性化は炎症性腸疾患のみならず、多くの自己免疫疾患の病態形成に関与することが知られていることから、本知見は亜鉛を用いた炎症性腸疾患治療の再考に役立つだけでなく、その他多くの自己免疫疾患に対する治療戦略構築に対して有用な情報となることが期待される」と、述べている。
▼関連リンク
・石川県立大学 研究トピック




