構造が複雑なアシルセラミドは、合成経路が完全に解明されていない
北海道大学は1月21日、皮膚における透過性バリア(皮膚バリア)の形成において最も重要な脂質であるアシルセラミドの産生過程で不明だったアシルCoA合成酵素遺伝子(FATP4)の同定に成功したと発表した。この研究は、同大大学院薬学研究院の木原章雄教授らの研究グループによるもの。研究成果は、「Proceedings of the National Academy of
Sciences of the United States of America」(米国科学アカデミー紀要)に掲載されている。
画像はリリースより
ヒトの皮膚に存在する皮膚バリアは、病原体、アレルゲン、有害物質の侵入を阻止し、体内からの水分の蒸発も防いでいる。やけどやけがなどで皮膚バリアが壊されると、感染のリスクが著しく増加する。遺伝子異常によって皮膚バリアの形成が損なわれた疾患として、先天性魚鱗癬がある。アトピー性皮膚炎患者でも魚鱗癬ほどではないが、皮膚バリア機能が低下しており、アレルゲンが侵入しやすくなっている。
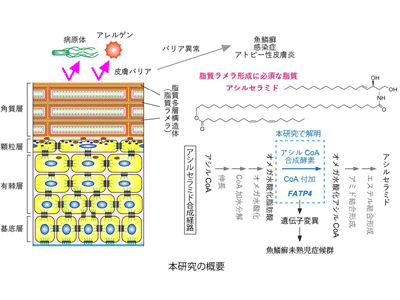
脂質にはさまざまな種類、さまざまな機能があり、水に溶けない性質を活かした透過性バリアとしても重要な役割を果たしている。脂質の一種であるセラミドは、全身に存在するが、特に皮膚の最も外側の角質層(角層)に多量に存在し、皮膚バリア形成に極めて重要な働きを担っている。セラミドにもさまざまな種類があり、その中でもアシルセラミドは皮膚バリア形成に特化した「バリア脂質」として皮膚バリア形成に必須だ。
皮膚は外側から表皮、真皮、皮下組織に分かれる。また、表皮はさらに4層(外側から角質層、顆粒層、有棘層、基底層)に分かれ、最も外側の角質層に脂質の多層構造体(脂質ラメラ)が存在し、角質層に存在する細胞の間を埋めている。この脂質ラメラこそが、皮膚バリア機能に最も重要な構造体であり、この多層構造体を形成するためにはアシルセラミドが必要とされている。通常のセラミドが2本の炭化水素鎖構造(1本の長鎖塩基と1本の脂肪酸)を持っているのに対して、アシルセラミドは3本の炭化水素鎖(1本の長鎖塩基と2本の脂肪酸)からなる複雑な構造を持つ。通常のセラミドを産生する酵素及びそれらをコードする遺伝子についてはすでに明らかにされていた。一方、アシルセラミドは複雑な構造を持つため、その産生のためには通常のセラミドよりも多くの化学反応とそれを触媒する酵素が必要だが、それらは長い間不明だった。
魚鱗癬未熟児症候群の原因遺伝子FATP4のKOで皮膚バリア機能異常
研究グループは以前、アシルセラミド合成に関わる多くの酵素の遺伝子を明らかにし、アシルセラミド合成の産生経路と産生に関わる反応を予測した。その中で、まだ不明な酵素として残っていたのが、今回の研究で解明したアシルCoA合成酵素(脂肪酸にCoAを付加する反応を触媒)だった。ヒトには26種類のアシルCoA合成酵素が存在する。その中の1つが今回の研究によってアシルセラミド合成に関わることが明らかになったFATP4だ。FATP4遺伝子が変異すると魚鱗癬未熟児症候群(未熟児として出生し、呼吸困難、皮膚での魚鱗癬を伴う)が引き起こされる。FATPは、元々は脂肪酸を細胞に輸送する機能があると推定されていた。そのため、これまでは魚鱗癬未熟児症候群の発症のメカニズムとして皮膚への脂肪酸取り込みが低下することが原因という仮説が有力だった。しかし、研究グループはこれまでとは全く異なった新たな仮説(FATPがアシルセラミド合成に直接関与する)を打ち立て、今回の研究で証明した。
研究グループはまず、FATP4タンパク質をコードする遺伝子を欠損したFatp4 KOマウスを作成。このマウスは生後すぐに死亡した。Fatp4 KOマウスの皮膚は、野生型マウスに比べてしわが少なく張っており、Fatp4 KOマウスの皮膚を介した体内からの水分蒸散量は、野生型マウスの約4.4倍増加していた。トルイジンブルー染色により体外から体内への皮膚透過性バリア機能を調べたところ、野生型マウスでは色素の浸透は見られなかったのに対し、Fatp4 KOマウスでは強い浸透が見られた。これらの結果により、Fatp4 KOマウスの皮膚バリア機能に異常があることが示された。
アシルセラミドの産生経路と魚鱗癬未熟児症候群における皮膚症状の発症原因を解明
次に、ヘマトキシリン/エオジン染色により、Fatp4 KOマウスの表皮の形態異常の有無を解析。結果、野生型マウスの角質層では脂質ラメラの存在を示す角質細胞間の間隙が観察され、10層未満の角質層が存在していた。一方、Fatp4 KOマウスでは角質層の数の増加が観察され、脂質ラメラの存在を示す角質細胞間の間隙は不明瞭だった。また、透過型電子顕微鏡での観察により表皮の微細構造を解析したところ、Fatp4 KOマウスの角質層上部には魚鱗癬未熟児症候群患者にも見られる空胞や異常な繊維状の膜構造体が観察された。これらの結果は、Fatp4 KOマウスでは脂質ラメラ形成を含む角質層の形成に異常があることを示している。
さらに、Fatp4遺伝子欠損がアシルセラミド産生に与える影響を調べるために、表皮中のアシルセラミド量を質量分析で解析。その結果、Fatp4 KOマウス中でのアシルセラミド量は、野生型マウスの約9.8%にまで低下していた。一方、Fatp4 KOマウスの表皮における脂肪酸量は野生型マウスと比較して減少しておらず、むしろ増加していた。これにより、これまで提唱されていた脂肪酸取り込みの低下が魚鱗癬発症のメカニズムであるという仮説が否定されたという。また、ヒトの角化細胞でも、Fatp4 KOマウスで観察されたアシルセラミドの減少は見られるのかを、FATP4遺伝子をノックダウンさせて調べたところ、アシルセラミド量が約40%減少した。
アシルセラミド産生経路においては、オメガ位が水酸化された脂肪酸がアシルCoA合成酵素の基質となる。そこで、FATP4が実際にこのような脂肪酸をアシルCoAへ変換させる活性を持つかどうかを調べるため、酵素活性測定を実施。測定にはFATP4を過剰発現させた細胞から調製した生体膜成分(膜画分)を用い、コントロールとしてはFATP4を過剰発現させていない膜画分を使用した。その結果、FATP4を過剰発現させた膜画分はコントロールに比べ、10.5倍量のアシルCoA産生活性を示した。以上の結果から、FATP4がアシルセラミド産生経路において働くアシルCoA合成酵素であることが明らかとなり、アシルセラミド合成経路中にオメガ水酸化脂肪酸をオメガ水酸化アシルCoAへ変換する反応が存在するという、研究グループが予測したアシルセラミド産生経路の妥当性も示された。
今回の研究は、皮膚バリア形成に最も重要な脂質であるアシルセラミドの産生経路を解明し、皮膚におけるバリア形成の分子機構の解明に大きく寄与した。難病である魚鱗癬には有効な治療薬が存在しない。また、アトピー性皮膚炎も対症療法に頼っているのが現状。これらの疾患はいずれも皮膚バリアの異常が原因となっているので、その異常を元に戻せるような治療薬(例えば、アシルセラミドあるいは類似化合物の皮膚への塗布、生体内のアシルセラミド産生を増やすような薬)が開発されれば、有効な魚鱗癬治療薬やアトピー性皮膚炎の原因療法が可能となると期待される。
▼関連リンク
・北海道大学 プレスリリース




