困難とされていた細いフィラメントの構造解析
大阪大学は1月9日、ヒト心筋の細いフィラメントにおける収縮弛緩の制御メカニズムを分子レベルで明らかにしたと発表した。これは、同大大学院生命機能研究科の山田有里佳特任研究員、難波啓一特任教授、藤井高志特任准教授(常勤)の研究グループによるもの。研究成果は米国科学誌「Nature Communications」のオンライン版に掲載されている。
画像はリリースより
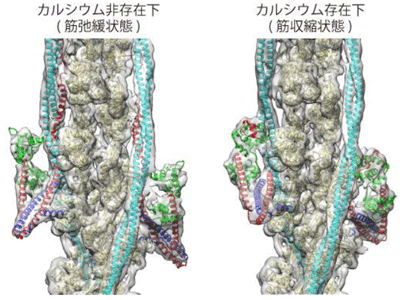
1960年代に江橋節郎博士が、筋肉の収縮装置にカルシウムイオンで駆動する制御スイッチが存在すること、そのスイッチの鍵となるのがアクチンで構成される細いフィラメント上に存在するトロポニンであることを発見して以降、筋収縮のカルシウム調節機構の詳細なメカニズムを明らかにするため、さまざまな生化学、生理学研究や構造研究が行われてきた。細いフィラメントの構造研究では、アクチン、トロポミオシン、トロポニンのそれぞれ単体について、X線や電子顕微鏡により構造解析が行われていたが、フィラメント全体の構造はほとんど見えていなかった。
この構造を可視化できる唯一の方法が、最近急速に進歩したクライオ電子顕微鏡の単粒子像解析法だが、トロポミオシンはきわめて細長く、トロポニンも小さな分子であり、しかも、アクチン繊維・トロポミオシン・トロポニン複合体の構造が不安定であるため、細いフィラメントの構造解析は大変困難な課題とされていた。
心筋症の原因解明や治療法の開発への応用に期待
研究グループは今回、クライオ電子顕微鏡と画像解析法の工夫を重ね、ヒト心筋の細いフィラメントの立体構造解析に成功。トロポニンC, I, Tの3分子からなるトロポニンがトロポミオシンと同程度に細長い分子であることや、トロポミオシンとともにアクチン繊維に結合している様子を明らかにした。さらに、Ca2+存在下と非存在下の2状態における細いフィラメントの構造を解明し、収縮弛緩の制御に関わるトロポニンとトロポミオシンの構造変化を可視化することに成功した。
肥大型・拡張型心筋症などの特発性心筋症は原因不明のものが多く、遺伝的な要因が関与していることが知られている。また、これらはトロポニンの変異により、筋収縮のCa2+制御機能の異常を引き起こしていると考えられている。今回の研究成果を基盤として今後の研究が発展すれば、アクチンやトロポミオシン、トロポニンの変異によって引き起こされる心筋症の原因解明や治療法の開発への応用が期待される。
▼関連リンク
・大阪大学 研究情報



