CKDと体内時計との関連をモデルマウスで解析
早稲田大学は1月14日、慢性腎臓病モデルマウスを用い、慢性腎臓病により中枢や末梢臓器の体内時計の乱れが起き、それにより睡眠・覚醒パターンや血圧、腎機能の昼夜差が失われ、結果として腎機能をさらに悪化させることを発見したと発表した。この研究は、同大理工学術院の田原優准教授および本橋弘章氏、横浜市立大学医学部の涌井広道講師、University of California Los AngelesのChristopher S. Colwell教授の研究グループによるもの。研究成果は、「Kidney International」に掲載されている。
画像はリリースより
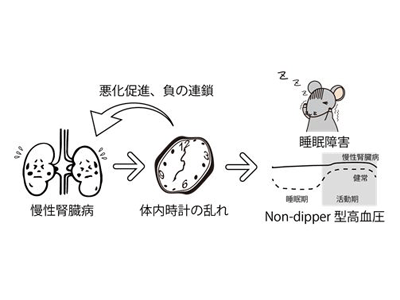
慢性腎臓病(chronic kidney disease:以下、CKD)は患者数が年々増加しており、日本人のCKD患者数は約1330万人と推計されている。また、腎機能は一度低下すると回復することは難しく、血液を濾過する透析のみが腎機能を維持する唯一の対処法。そのため、CKDの発症予防、または悪化の予防が重要となっている。一方で腎臓病患者は、夜間の中途覚醒、睡眠の質低下、睡眠時間の減少、昼間の過度な眠気といった睡眠障害がしばしば見られ、体内時計(概日時計)の乱れが起きている可能性があった。体内時計、つまり時計遺伝子は、腎臓でも24時間の時を刻んでおり、血液からの老廃物の濾過、尿の生成、血圧調節などを制御している。しかし、CKDと時計遺伝子の関連、さらには睡眠障害との関連については明らかになっていなかった。
CKDマウスで日内リズムが減弱、Clock変異CKDマウスでは腎機能がさらに悪化
そこで研究グループは、まず、アデニン誘発性のCKDモデルマウスを用いて、体内時計の変化や睡眠障害について解析を行った。その結果、CKDモデルマウスでは、活動量の低下、睡眠の断片化(中途覚醒の増加)、飲水行動・尿の増加が見られた。中枢時計では、時計遺伝子Period2(ピリオド2)の発現の日内リズムが減弱していたことから、これらの睡眠・行動の変化は中枢時計の減弱によるものと考えられた。さらに、腎臓の時計遺伝子、時計制御下の遺伝子発現の日内リズムも減弱していた。CKD患者では高血圧が起こるが、CKDモデルマウスでも高血圧、かつ低心拍数を示すと共に、睡眠時に血圧が低下しないnon-dipper型の変動を示した。この結果は、CKD患者で多く見られるnon-dipper型高血圧を再現していると共に、本研究で見られた体内時計の乱れがnon-dipper型、つまり、日内リズムの消失を引き起こしている可能性を示唆している。
次に、時計遺伝子のひとつであるClock(クロック)の変異マウスを用いて、同様にアデニン誘発性のCKDモデルマウスを作製し、体内時計の乱れが腎臓病の発症、進行に影響を与えるのかについて検討した。結果、通常のマウス(WT)で作成したCKDモデルマウスに比べ、Clock変異CKDモデルマウスでは腎機能マーカーの悪化(尿中クレアチニン値低下、血清尿素窒素上昇など)、炎症・線維化マーカーの悪化がより顕著だった。特に、Clock変異CKDモデルマウスにおいて、細胞外基質の分解酵素であるMMP-2/9(ゼラチナーゼ)の活性が高く、アデニン代謝物の腎臓内蓄積が多いことが悪化の原因と考えられた。
研究グループは、「体内時計の乱れが腎臓病悪化の一因であるという今回の研究結果から、普段の生活習慣を規則正しく整え、体内時計の健康維持を目指すことが、腎臓病悪化の予防につながる可能性がある」と、述べている。
▼関連リンク
・早稲田大学 トピック



