PiT-2をコードするSLC20A2遺伝子の変異、家族性IBGC患者の約半数に
日本医療研究開発機構(AMED)は1月10日、SLC20A2遺伝子の1つの変異でリン酸の輸送活性が約30%まで低下していても、神経変性疾患である特発性基底核石灰化症(idiopathic basal ganglia calcification: IBGC)の脳内石灰化や症状を全く呈していないことを見出したと発表した。この研究は、岐阜薬科大学薬物治療学のIBGC研究グループ(西飯和哉氏、下川梨津子氏、栗田尚佳氏、位田雅俊氏、保住功氏)が中心となり、国立病院機構あきた病院神経内科の小林道雄氏、豊島至氏、富山大学病院神経内科(現 たぐちクリニック)の田口芳治氏、藤田医科大学神経内科の植田晃広氏、東京都立多摩総合医療センター精神神経科の田宗秀隆氏との共同研究で行われたもの。研究成果は、英国科学誌「Scientific Reports」に掲載されている。
画像はリリースより
IBGCは、脳内に石灰化を来す原因となる二次的な疾患がなく、原発性に両側の大脳基底核、小脳歯状核などに病的な石灰化を示す神経難病。2012年に中国の研究グループが家族性IBGC(FIBGC)の原因となる遺伝子として、無機リン酸を細胞内へ輸送するリン酸トランスポーター(PiT-2)をコードするSLC20A2遺伝子の変異を報告した。その後も相次いで原因遺伝子の報告があり、現在、PDGFRB、PDGFB、XPR1、MYORGと、計5つの原因遺伝子が報告されている。SLC20A2遺伝子の変異は家族性IBGC患者のうち最も頻度が高く、約半数(40~50%)を占める。研究グループは以前にIBGC患者の全体、特にSLC20A2遺伝子の変異をもつ患者の脳脊髄液中のリン酸濃度が、健常者に比べ有意に増加していることを見出している。こうした知見から、SLC20A2遺伝子の変異によってPiT-2のリン酸の輸送能が障害され、細胞内外のリン酸代謝の恒常性の破綻が契機となり、脳内石灰化を含むIBGCの病態を引き起こすと考えられている。しかし、現在、IBGCの根本的な治療薬はまだ見つかっておらず、IBGCのさらなる病態の解明と根本的な治療法の開発が求められている。
IBGC家系内の非発症例で見出したSLC20A2変異では、活性が正常の約30%保持
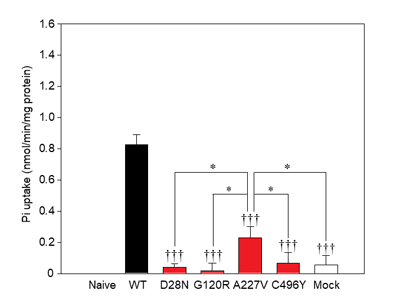
今回、研究グループは、まずIBGC患者と患者家族の血液から遺伝子を抽出し、4つのSLC20A2遺伝子の変異を同定した。これらの変異が与える影響を変異解析ソフトPolyphen-2で解析したところ、4つ全ての変異においてタンパク質の機能に障害を及ぼす可能性が示唆された。次に、変異遺伝子の機能解析をするため、正常コントロール(野生型)のPiT-2、変異型のPiT-2をそれぞれ安定的に発現するChinese Hamster Ovary (CHO)細胞を樹立。樹立した安定的な発現株を用いてPiT-2のリン酸の輸送活性を測定したところ、IBGC発症者の遺伝子変異型PiT-2が発現した細胞では、リン酸の輸送活性が著しく低下していた。一方で、IBGC家系内の脳内石灰化や症状が認められない、非発症例で見出した遺伝子変異においては、野生型PiT-2の約30%のリン酸の輸送活性が保持されていることを見出した。以上の結果から、PiT-2のリン酸の輸送活性が変異によって部分的に低下しても、IBGCの病態を引き起こさない可能性が示唆された。
今回の研究により、PiT-2が持つリン酸の輸送活性の部分的な低下では、IBGCの病態を示さないことが明らかとなった。この事実から、リン酸の輸送活性を完全ではなくとも部分的に上昇させることで、IBGCの病態の改善につながる可能性が期待できる。一方で、治療法を考える上で解決すべき課題も多く残っている。IBGC患者においてSLC20A2遺伝子の変異は常染色体優性遺伝であり、野生型PiT-2と変異型PiT-2の両方が発現していると考えられている。そのため、変異型PiT-2が野生型PiT-2に対して示す優性阻害効果、あるいはハプロ不全によるPiT-2の発現量の相対的な低下によって、IBGCが発症しているかどうかについてはまだ議論が続いている。現在、さらなるIBGCの解明に向けて、岐阜薬科大学薬物治療学研究室を中心に、東京大学、京都大学、新潟大学脳研究所などと連携して、現在、IBGC患者から樹立した疾患特異的なiPS細胞や遺伝子変異の疾患モデルマウスを作製して、より詳細な発症機構の解明や治療薬の開発について研究が進められている。
▼関連リンク
・日本医療研究開発機構(AMED) 研究成果



