SOD1の構造異常化が、ALS発症の引き金となる要因について研究
慶應義塾大学は12月26日、筋萎縮性側索硬化症(ALS)の発症に関わる銅・亜鉛イオン結合タンパク質SOD1について、その立体構造が異常化する新たなメカニズムを提唱したことを発表した。この研究は、同大理工学部の古川良明准教授、徳田栄一助教(研究当時。現・日本大学薬学部専任講師)、大学院理工学研究科の安齋樹(2019年博士後期課程修了)らの研究グループが、同大薬学部の三澤日出巳教授、自然科学研究機構分子科学研究所の秋山修志教授らと共同で行ったもの。研究成果は、国際科学誌「Free Radical Biology and Medicine」のオンライン版に掲載されている。
画像はリリースより
銅・亜鉛スーパーオキシドディスムターゼ(SOD1)は、銅・亜鉛イオンを結合する金属タンパク質で、反応性の高い活性酸素であるスーパーオキシドを酸素分子と過酸化水素に変換する重要な役割を担っている。神経難病である筋萎縮性側索硬化症(ALS)の患者の一部では、SOD1をコードする遺伝子に変異が認められ、異常な立体構造を持つ(ミスフォールドした)SOD1が脊髄の運動神経に蓄積することが知られている。また、SOD1をコードする遺伝子に変異が認められない原因不明の孤発性ALS患者においても、毒性の高いミスフォールドしたSOD1が脳脊髄液から検出されることを、私たちの研究グループから報告している。つまり、SOD1の構造異常化(ミスフォールディング)は、ALSの発症に関与している可能性が考えられるが、その引き金となる要因は明らかとなっていない。
ALSの治療・予防薬開発への貢献に期待
そこで研究グループは、ALS患者の脊髄やそれを取り巻く脳脊髄液では、酸化ストレスを示すマーカーの値が非常に高く、さまざまな生体分子が酸化されやすい状況にあることに着目。特に、SOD1が産生する過酸化水素は酸化剤として機能することから、SOD1は酸化されることでミスフォールドするのではないかと考えた。
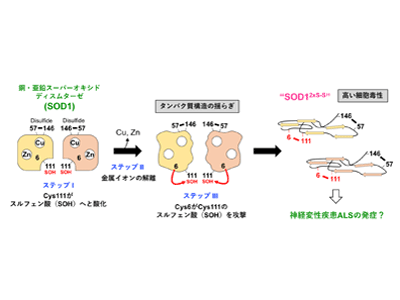
タンパク質を構成するアミノ酸の中で、システインは最も酸化されやすいことが知られている。SOD1には4つのシステインがあるが、正常なSOD1では、そのうちの2つ(Cys57とCys146)が酸化されて「ジスルフィド(S-S)結合」を形成し、立体構造の安定化に寄与している。残りの2つのシステイン(Cys6とCys111)は酸化されずに存在するのが普通だが、SOD1が産生する過酸化水素によって、Cys111はスルフェン酸と呼ばれる状態に酸化されることがわかった。さらに、結合していた銅イオン・亜鉛イオンが解離すると、タンパク質構造が大きく揺らぎ、通常は遠く離れた位置にあるCys6がCys111のスルフェン酸を攻撃して、Cys6とCys111の間でS-S結合が形成した。つまり、酸化ストレスの増大と銅・亜鉛イオンの解離によって、2つのS-S結合を持った異常なSOD1(SOD12xS-S)が形成することを見出した。このSOD12xS-Sは、凝集して不溶性の沈殿になりやすく、運動ニューロン様の培養細胞であるNSC-34に添加すると毒性を示すことから、正常なSOD1にはない性質を有することがわかった。
今回の研究では、酸化ストレスの増大と金属イオンの解離によって、SOD1タンパク質は分子内に新たなS-S結合を形成したSOD12xS-Sへとミスフォールドする新たなメカニズムを提案することができた。SOD12xS-Sは高い細胞毒性を発揮することから、ALSの発症に関与する可能性が考えられるが、ALS患者から実際に検出されるのかを今後さらに検証する必要がある。運動ニューロンの変性に関わるSOD1のミスフォールド構造やその形成メカニズムについて知見を得ることで、ALSの治療・予防薬開発に対して基礎科学的な面からの貢献が期待される。
▼関連リンク
・慶應義塾大学 プレスリリース



