注目される、血液脳関門の機能制御
理化学研究所(理研)は12月20日、脳内の免疫細胞であるミクログリアが血液脳関門の機能を制御することを発見し、そのメカニズムを初めて明らかにしたと発表した。この研究は、名古屋大学大学院医学系研究科の和氣弘明教授(神戸大学先端融合研究環特命教授)らのグループが、同大大学院医学系研究科の木山博資教授、自然科学研究機構生理学研究所の鍋倉淳一教授、自治医科大学の大野伸彦教授、ニューサウスウェールズ大学のAndrew J Moorhouse博士らの協力を得て行ったもの。研究成果は、英科学誌「Nature Communications」に掲載されている。
画像はリリースより
脳内の血管は、「血液脳関門」と呼ばれる特殊な仕組みを有しており、これが全身を巡る循環系と中枢神経系の環境を隔てるバリアとして機能している。血液脳関門が、感染症や自己免疫疾患などの慢性的な炎症によって機能低下すると、神経の活動に影響を及ぼすことがある。近年、パーキンソン病やアルツハイマー型認知症、統合失調症などの精神・神経変性疾患において、この血液脳関門機能の異常が示されているため、血液脳関門の機能制御はこれらの疾患の予防法・治療法につながる可能性があるという。
研究グループはこれらのことを明らかにするため、生きたマウスを用いて、全身性の炎症に伴って血液脳関門の機能が破綻する過程の観察を行った。
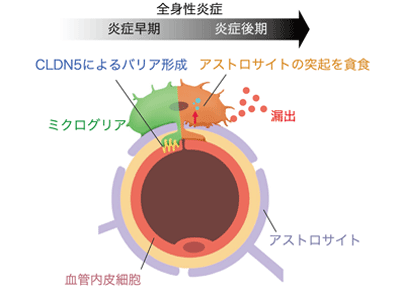
CLDN5を発現したミクログリアが、ホースの水漏れをふさぐように血管内皮細胞に密着
まず、生きたマウスの脳を観察可能な生体2光子顕微鏡を用いて、全身性の炎症が誘導されたモデルマウスのミクログリアを経日的に同一部位を観察し、その動きと血管の透過性を観察することで、ミクログリアの血液脳関門への影響を調べた。
最初に炎症が持続している自己免疫疾患のモデルマウスの脳を観察したところ、血管に密着したミクログリアが多く存在するため、炎症によりミクログリアが血管に集積すること、それに伴って、血液脳関門の透過性が変化することがわかった。また、ミクログリアを除去したマウスにおいては、早期には血液脳関門の透過性が増加し、その後においては透過性が抑制されていることが判明した。
これらの詳細な分子メカニズムを明らかにするために網羅的に遺伝子を解析し、早期においては細胞の接着に重要な分子であるクローディン5(CLDN5)がミクログリアに発現し、後期相においては貪食に関わる分子であるCD68が、ミクログリアに発現することがわかった。さらに、最新の電子顕微鏡を用いてミクログリアと血管の微細構造を観察すると、細胞の接着に重要な分子であるCLDN5を発現したミクログリアが、血管内皮細胞に密着していることがわかった。これにより、ミクログリアが自ら、破れたホースの水漏れを抑えるシールのように働いていることが明らかになった。また、ミクログリアは血管内皮細胞から放出されるケモカインであるCCL5に応答して血管に誘引し、CLDN5を発現していることも明らかとなった。CCL5を阻害することにより、ミクログリアの血管への集積が起こらず、結果として血液の漏出が早まる現象も観察された。
さらに、ミクログリアは貪食に関わる分子であるCD68を発現し、血液脳関門を構成するアストロサイトという細胞の突起を一部貪食していることを発見。アストロサイトの突起は血液脳関門の維持に重要であることが知られており、この構造の破綻をきっかけに漏出が引き起こされると考えられるという。
最後に、ミクログリアの活性化を抑制する抗生物質として知られる「ミノサイクリン」をマウスに投与したところ、ミクログリアの血管への集積と初期の血液脳関門の保護に影響を及ぼすことなく、慢性期の漏出悪化を抑制できることが明らかになった。
ミクログリアを標的とした新しい予防法・治療法の開発への貢献に期待
これらの結果から、脳内の免疫細胞であるミクログリアが全身性の炎症に伴って血管に集積し、炎症の段階によって、血液脳関門に保護的にも障害性にも作用することが明らかになった。さらにそのメカニズムとして、ミクログリアによる血管内皮細胞との直接の接触や、アストロサイトの突起の貪食が起こっていることを初めて明らかにした。
今回の研究成果により、全身性の炎症が慢性化した際、ミクログリアの過剰な活性化を制御することが、血液脳関門の保護に効果的であることが示された。さらに、ミクログリアは単に漏出を悪化させるだけでなく、炎症初期の漏出の抑制にも重要な役割を担っており、保護的な側面を持ち合わせていることが明らかになった。「本研究の成果は、全身性の炎症が原因となる中枢神経系の疾患において、ミクログリアを標的とした新しい予防法・治療法の開発に貢献することが期待される」と、研究グループは述べている。
▼関連リンク
・名古屋大学 プレスリリース




