従来のげっ歯類モデルではヒトの病態を正確に再現できず
京都大学は12月13日、霊長類の一種カニクイザルにおいて、常染色体優性多発性嚢胞腎(ADPKD)の病態再現に成功したと発表した。この研究は、同大学高等研究院ヒト生物学高等研究拠点(ASHBi)の築山智之研究者(兼・滋賀医科大学特任准教授)、依馬正次同主任研究者(兼・同教授)らの研究グループによるもの。研究成果は、国際学術誌「Nature Communications」オンライン版に掲載された。
画像はリリースより
ADPKDは頻度の高い遺伝的疾患のひとつ。世界の患者数は600万人と推定されており、その半数以上が60歳までに末期腎不全に至り、透析療法や腎移植が必要となる深刻な疾患だ。これまで、動物モデルや培養細胞モデルを用いた研究により、さまざまな治療法が提案され、病態の進行をある程度抑えることは可能になってきているが、依然として根治法は存在していない。
また、小動物とヒトにおいて、開発されたADPKD治療薬に対する反応が異なることが多い。これは、小動物とヒトにおける、生理的、遺伝的な違いに起因していると考えられる。ヒトのADPKD患者の多くは、PKD1変異を片親から受け継いだヘテロ接合体であり、幼少期から嚢胞発生が認められるのに対し、PKD1のヘテロ接合体マウスでは、寿命近くになるまで嚢胞が発生しないことがわかっている。よって、マウスなどのげっ歯類モデルではヒトの病態を正確に再現できないと言える。
そこで、同研究では、実験的操作が可能な動物種の中で最もヒトに近い霊長類カニクイザルにおいて、CRISPR/Cas9法を用いたゲノム編集により、PKD1遺伝子の変異誘導を行い、ADPKDモデルを作製した。
従来の治療標的とは異なる「遠位尿細管」を標的とする新規薬剤開発に期待
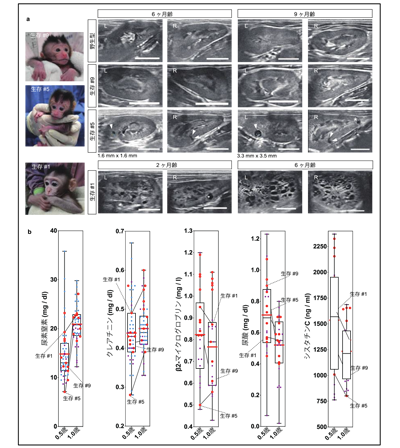
研究の結果、PKD1遺伝子の完全な変異誘導(ノックアウト)では、ヒトやマウスにおける従来の研究と同様に、主に集合管において深刻な嚢胞形成が起きることを示した。一方、PKD1遺伝子のヘテロ接合体変異では、遠位尿細管から嚢胞形成が起きることを示し、従来のマウスにおける研究では成し得なかった、ヒトにおける病態の最初期の再現に成功した。
また、さまざまな深刻度の嚢胞形成を示すADPKDモデルサルの作製に成功。経過観察の結果、加齢とともに嚢胞が拡大することを確認した。遺伝子が存在している領域である遺伝子座(アレル)特異的ターゲティングを用いて、ヘテロ接合体変異を持つサルを選択的に作製することに成功し、大きなDNA断片の標的遺伝子挿入(ノックイン)にも成功した。
同研究でヒトにおける病態の最初期の再現に成功したことから、今後、同研究成果は病態進行メカニズムの理解に貢献することが期待される。これにより、「従来治療標的とされてきた集合管ではなく、遠位尿細管を標的とする新規薬剤の開発が期待され、作製されたサルモデルは、現在治療法のない小児患者に向けた新しい治療戦略を確立するための技術基盤となることが期待される」と、研究グループは述べている。
▼関連リンク
・京都大学 プレスリリース




