がんとの関連が知られるMN1遺伝子、ヒトの先天性奇形との関連は?
横浜市立大学は12月13日、中枢神経異常と特徴的な頭蓋顔面異常をきたす新たな先天性奇形症候群の原因となる遺伝子MN1を同定したと発表した。この研究は、同大学術院医学群遺伝学の三宅紀子准教授、松本直通教授らの研究グループが、同医学群分子生物学の高橋秀尚教授、生化学の緒方一博教授、組織学の富澤信一講師、同大先端医科学研究センターの木村弥生准教授、山形大学医学部附属病院の中村和幸医師、Centre Hospitalier Universitaire de NantesのBertrand Isidor医師、広島市こども療育センターの平木洋子医師との共同研究として行ったもの。研究成果は、「American Journal of Human Genetics」に掲載されている。
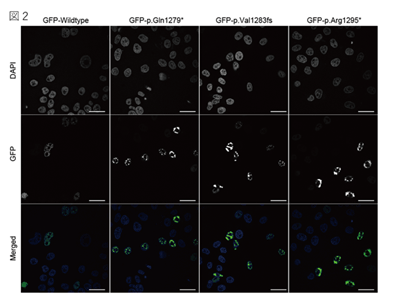
画像はリリースより
MN1遺伝子は転写制御因子のひとつであるMN1タンパク質をコードしている。この遺伝子は、髄膜腫や骨髄増殖性疾患において染色体の転座により切断されているとの報告があり、がん抑制遺伝子として知られる一方、予後が悪い急性白血病でMN1遺伝子が高発現していることも報告されており、がん遺伝子との報告もあった。また、Mn1遺伝子ノックアウトマウスの研究により、頭蓋顔面異常の発生にMn1遺伝子が重要であることが示唆されていたが、ヒト疾患遺伝子としては確立していなかった。
新たな臨床像の3症例を全エクソーム解析し、MN1の機能獲得型変異を同定
今回、研究グループは、精神・運動の発達遅延、言語障害、特徴的な頭蓋顔面異常(長頭症、平坦な顔、眼間解離、耳介低位、上向きの鼻孔など)、過食症、脳構造の異常を呈する新たな臨床像を呈する3症例を対象に、全エクソーム解析を用いて遺伝子変異の解析を実施。その結果、3症例それぞれにMN1遺伝子のエクソン2に短縮型変異を認めた。
MN1遺伝子は2つのエクソン領域から構成されるが、健常者もしくはコントロール集団に認められた短縮型変異は、すべてエクソン1に存在しナンセンス変異依存mRNA分解(NMD)を受けるため、MN1タンパク質が産生されないのに対し、患者に同定された変異はエクソン2にありNMDを受けないため、C末端の欠けた短いMN1タンパク質が産生されることが判明。もともとMN1タンパク質は細胞増殖を抑制することが知られていたが、変異型を導入すると野生型よりも強く細胞増殖抑制効果が認められ、今回の変異が機能獲得型変異(細胞増殖抑制の増強)であることがわかった。
転写制御に異常をきたすことが発症メカニズムの一因
変異MN1タンパク質は、野生型と同様に転写活性を保持していたが、野生型より安定して細胞内に存在し、核内で凝集体を形成しやすい傾向にあった。その凝集体が弱い疎水結合を阻害する溶媒(1,6-ヘキサンジオール)により可逆的に消失することから、MN1タンパク質が相分離を呈する分子であることがわかった。MN1タンパク質は大部分が特定の三次構造を持たない天然変性領域から構成されており、C末端にある三次構造をとる領域の欠損により天然変性領域の占める割合が増えることと、タンパク質の安定性が増し細胞内での濃度の上昇により凝集体が増加することが考えられ、MN1タンパク質による転写制御に相分離が関与している可能性が示唆された。
また、一連の機能解析により①MN1タンパク質が転写因子PBX1、PKNOX1、ZBTB24に結合すること、②MN1タンパク質は通常RING1を含むユビキチンプロテアソーム系により速やかに分解されていること、③変異MN1タンパク質では、ZBTB24とRING1との結合が阻害されていることが明らかとなった。
以上より、今回解析した症候群発症のメカニズムとして、C末端が消失するMN1遺伝子の変異によりRING1との結合が阻害され、タンパク質の安定性が増し、通常のMN1タンパク質による転写制御のON、OFFのスイッチが適切に切り替わらないことで、下流の遺伝子の転写制御に異常をきたすことが考えられた。研究グループは、「今回、新たな先天性奇形症候群の原因となる遺伝子が同定されたことで、本症候群の病態解明と診断法・治療法の開発へ大きな寄与が期待され、また、現在注目されているヒト疾患における相分離の役割の理解が進むことが期待される」と、述べている。
▼関連リンク
・横浜市立大学 プレスリリース






