細胞内ウイルスセンサータンパク質LGP2は、機能不明だった
東京大学は12月9日、ウイルス感染により、発現量の増加した細胞内ウイルスセンサータンパク質LGP2が、RNAサイレンシングの促進因子であるTRBPと相互作用することで、TRBPが結合していた特定のマイクロRNAの成熟過程を阻害することを見出したと発表した。この研究は、同大大学院理学系研究科の高橋朋子客員共同研究員(研究当時:助教)、中野悠子大学院生(研究当時)、程久美子准教授、および、千葉大学真菌医学研究センターの尾野本浩司助教、米山光俊教授らの研究グループによるもの。研究成果は、「Nucleic Acids Research」に掲載されている。
画像はリリースより
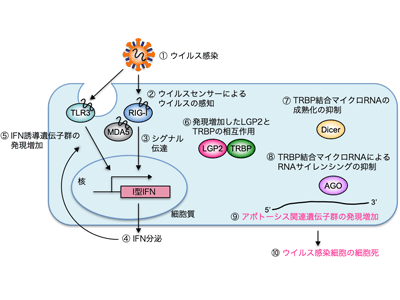
ヒトの細胞にウイルスが感染すると、細胞外または細胞内でそれぞれのウイルスセンサータンパク質がウイルス特有の構成成分を認識し、抗ウイルス性サイトカインの一種であるI型インターフェロン(IFN)の発現を誘導する。IFNは数百のIFN誘導遺伝子群(IFN-stimulated gene, ISG)と呼ばれるタンパク質の発現を誘導し、ウイルスから生体を防御する。細胞内ウイルスセンサータンパク質の中でLGP2は、その他のウイルスセンサータンパク質が持つIFNの誘導に必要なシグナル伝達に関わるタンパク質領域を持たないことから、これまで機能が不明だった。
一方、ヒトの細胞内には、長さ20数塩基のタンパク質をコードしない小さなRNA(マイクロRNA)が存在し、RNAサイレンシングと呼ばれる遺伝子発現制御機構によって多様な遺伝子機能を制御している。ヒトでは約2,000種類のマイクロRNAが存在しており、1つのマイクロRNAの欠損が、がんなどの重篤な疾患につながるなど、その機能の重要性が近年非常に注目されている。
LGP2がRNAサイレンシング促進因子TRBPと相互作用しアポトーシス誘導
今回の研究では、まず、センダイウイルスを感染させたヒト培養細胞において、細胞内ウイルスセンサータンパク質であるLGP2が約900倍発現増加すること、また、発現増加したLGP2がRNAサイレンシングの促進因子であるTRBPと相互作用することで、TRBPが結合する特定のマイクロRNAの成熟化を抑制することを見出した。その結果、センダイウイルス感染細胞では、TRBPが結合する特定の成熟型マイクロRNA量の減少が引き起こされた。
次にCRISPR/Casシステムにより樹立したヒトLGP2ノックアウト細胞またはTRBPノックアウト細胞を用いて、ウイルス感染細胞における遺伝子発現プロファイルをマイクロアレイで解析。その結果、LGP2とTRBPの相互作用を介して、アポトーシスに関与する遺伝子群が発現増加することが判明。さらにTRBPが制御するマイクロRNAの一つであるmiR-106bは、イニシエーターカスパーゼを含む複数のカスパーゼを直接的または間接的に制御しており、TRBP結合マイクロRNAの機能制御を介して、ウイルス感染細胞の細胞死が誘導されることが明らかとなった。
今回の研究により明らかとなったウイルスセンサータンパク質がマイクロRNAを介して細胞死を誘導する仕組みは、ウイルス感染細胞における新しい生体防御機構として機能していると考えられる。研究グループは、今回の成果について、「抗ウイルス治療や、近年臨床応用への期待が非常に高い核酸医薬開発への応用が期待される」と、述べている。
▼関連リンク
・東京大学大学院理学系研究科・理学部 プレスリリース



