浸潤、転移時のがん細胞が細胞骨格の形成、駆動力のメカニズムを解明
愛知医科大学は12月3日、がん細胞の運動能を生み出すのに必須なタンパク質として「STIL」を同定したと発表した。これは同大医学部病理学講座の伊藤秀明助教、笠井謙次教授らの研究グループが、京都大学大学院医学研究科病態生物医学の松田道行教授との共同研究によるもの。成果は、がん研究専門誌「Oncogene」オンライン版に掲載されている。
画像はリリースより
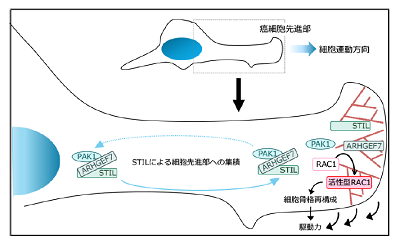
がん治療の難しさの1つに、臓器内での浸潤や別の臓器への転移の為、がんの存在範囲が広がることが挙げられる。こうした浸潤や転移は、がん細胞が「よく移動する(歩く)」という特性に基づく。そのため細胞運動能のメカニズムの解明は、浸潤、転移の制御法開発のための重要な基盤になると考えられてきた。細胞が「歩く」時には、RAC1などsmall GTPaseと呼ばれる因子を活性化し、細胞骨格と呼ばれる細胞の骨組みタンパク群を再構成することで、細胞膜の形状を変化させ、細胞進行方向への駆動力を生み出している。これまで国内外の多くの研究者が、がん細胞の細胞運動能に関わるさまざまなRAC1活性化因子を同定してきたが、がん細胞がどのように歩く方向を保ち、効率的に駆動力を生み出しているのかは十分に解明されていなかった。
STIL発現によりRAC1活性化、細胞運動能亢進、治療法開発に期待
研究グループは、生まれながら脳の発達が障害され頭部が小さくなる「小頭症」の原因遺伝子の1つ「SCL/TAL1 Interrupting Locus(STIL)」に着目。STILは膵臓がん、大腸がん、乳がんなど多様ながん種で発現増加している一方、その意味は不明な点も多い。
研究では、乳がん細胞を人工的に培養し、移動する様子を観察。すると、STILタンパク質が細胞先進部に集積することがわかった。そこで、同部への集積と細胞運動能への関与が知られていたRAC1活性化因子「ARHGEF7」および、リン酸化酵素「PAK1」との関係を調べたところ、ARHGEF7、PAK1、STILはいずれも「coiled-coil(CC)ドメイン」と呼ばれる短いタンパク領域を介して複合体を形成することが判明した。
また、RNA干渉法を用いてSTILタンパク質を人工的に失わせると、がん細胞の細胞先進部へのARHGEF7-PAK1集積やARHGEF7によるRAC1活性化、さらには細胞骨格再構成が阻害され、細胞運動能が著減した。一方、同様の方法でARHGEF7タンパク質を喪失させると、PAK1と共にSTILの細胞先進部への集積が阻害されることから、STILによるARHGEF7-PAK1の細胞先進部への集積と細胞運動能亢進は、正のフィードバック制御を受けていることがわかった。
さらに欧米の患者検体を用いたデータベース解析では、STIL発現増加と乳がん転移あるいは大腸がん再発が相関することから、STILを標的とする治療法が可能となれば、がん細胞の細胞運動能を抑制し、がんの浸潤や転移、再発を制御できる可能性が示唆された。
「STILによる細胞運動能亢進は、STILとARHGEF7-PAK1のCCドメインを介する複合体形成に基づくため、STILの機能、特にCCドメインを塞ぐ物質が同定できれば、STILとARHGEF7-PAK1複合体を離断させ、STIL依存性のがん細胞運動能の抑制、ひいては浸潤や転移、再発を制御できる可能性が示唆される」と、研究グループは述べている。
▼関連リンク
・愛知医科大学 プレスリリース




