多くのがんでみられるエピゲノム異常「H3K27me3蓄積」の仕組みは?
東京大学は11月20日、ATL、悪性リンパ腫、一部の固形がんなどで発がんを抑える遺伝子について、その発現が抑制される原因を特定し、さらに特異的に阻害する化合物を開発することで新たな治療法を提案したと発表した。この研究は、同大大学院新領域創成科学研究科の山岸誠特任講師、内丸薫教授、同大名誉教授の渡邉俊樹氏(フューチャーセンター推進機構特任研究員)、第一三共株式会社の本間大輔氏、荒木一司氏らの共同研究グループによるもの。研究成果は、米国科学雑誌「Cell Reports」に掲載されている。
画像はリリースより
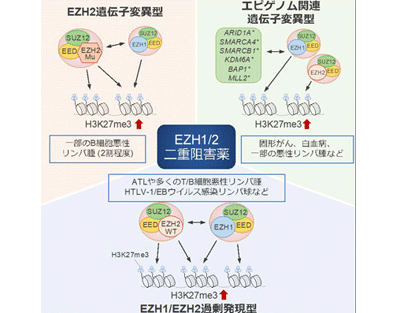
メチル化ヒストン(H3K27me3)の異常な蓄積によるエピゲノム異常は、多くのがんや造血器腫瘍で見られる代表的な性質。H3K27me3の変化によって非常に多くの遺伝子の発現パターンが変化し、腫瘍細胞の増殖能、走化/転移/浸潤能、分化異常、化学療法への耐性、宿主免疫からの逃避機構などのさまざまな特徴に対して、極めて重要な影響を及ぼすことがわかっている。
これまでに悪性リンパ腫、急性白血病などの造血器腫瘍や、乳がん、前立腺がん、肺がん、肝臓がん、膵臓がん、脳腫瘍などの多くの固形がんにおいて、H3K27me3が蓄積したエピゲノム異常が報告され、H3K27me3を誘導する複合体の中心的な酵素であるEZH2が、治療の標的となる分子の候補として研究が進んでいた。しかしながら、EZH2の遺伝子自体に異常を持たない大半の白血病、悪性リンパ腫、固形がんにおいて、H3K27me3がどのように蓄積するかは不明なままであり、高く持続的な治療効果の達成が重要な課題だった。
酵素EZH1とEZH2が協調してH3K27me3を蓄積させていた
今回東京大学の研究グループは、ATLや他の悪性リンパ腫において、H3K27me3を誘導するEZH1とEZH2の2つの酵素が腫瘍細胞内に共存することに気づき、両分子のクロマチン上の分布を解析した。その結果、両者は協調してH3K27me3を蓄積させることが判明。また、多くのがんで高頻度に見られるエピゲノムに関連した遺伝子の異常が、H3K27me3を蓄積させることもわかり、このプロセスにおいてもEZH1とEZH2が協調して機能することが明らかになった。
興味深いことに、EZH1またはEZH2のいずれかの遺伝子を不活性化すると、もう一方の酵素が失われた機能を補うことで高いレベルのH3K27me3の蓄積が保たれ、がん抑制遺伝子の発現も不活性化されたままだった。この2つの酵素が相互に機能を補う効果によって、がん細胞のエピゲノムが保たれる恒常性は、H3K27me3の蓄積を標的とした治療のコンセプトの障害となることが示唆された。
EZH1/2二重阻害薬を開発、薬事承認に向け臨床試験実施中
そこで東京大学の研究グループは、第一三共株式会社と共同でEZH1とEZH2の両方を阻害する新たな化合物(EZH1/2阻害物質)を開発し、ATLなどの多くの悪性リンパ腫や、エピゲノムに関連した遺伝子に変異を持つ多くの種類のがんに対して、有効である実験データを得た。新たな化合物は、EZH1とEZH2による相互の補償効果を打ち消すことで、従来のEZH2のみを阻害する薬と比較してH3K27me3を減少させる高い効果を示し、遺伝子の発現を正常化することで抗腫瘍効果を発揮した。さらに、予後が比較的良い慢性型またはくすぶり型のATLや、HTLV-1やEpstein-barr (EB)ウイルスに感染した前がん状態の細胞においても同様のエピゲノム異常が存在し、さらに新たな化合物(EZH1/2阻害物質)が有効であることも明らかとなった。今後、EZH1/2に依存したエピゲノム異常を標的とすることで、早期の治療介入や発症予防などへの展開が期待される。
第一三共株式会社は、ATLを含む再発難治T細胞リンパ腫に対するEZH1/2阻害薬(Valemetostat/DS-3201)の薬事承認に向けて、その第1相臨床試験を実施中であり、厚生労働省より先駆け審査の指定を受けている。また現在、再発難治ATLに対する第2相臨床試験の開始が予定されている。
研究グループは、「本成果は、本邦において基礎から臨床へと展開したトランスレーショナル研究であり、日本発の新薬の開発が進み、また臨床試験の結果によっては白血病や悪性リンパ腫などに罹患した多くの方々にとって大きな救いとなる可能性がある」と、述べている。
▼関連リンク
・東京大学大学院新領域創成科学研究科 ニュース



