老化に伴うエネルギー欠乏の原因にSHMT2が関与するかを検証
筑波大学は11月8日、ヒトの老化に伴うエネルギー欠乏に、核遺伝子SHMT2が関係していることに注目し、その仕組みをShmt2遺伝子破壊マウスを用いて解明したと発表した。この研究は、同大生存ダイナミクス研究センター(TARA)の林純一名誉教授らの研究グループによるもの。研究成果は、「Scientific Reports」の電子版に掲載されている。
画像はリリースより
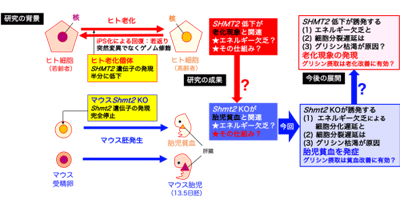
ヒトは老化に伴いエネルギー欠乏になるが、その原因についてはさまざまな仮説が提出されている。研究グループはこれまでに、「ヒトの老化に伴うエネルギー欠乏の原因が、突然変異ではなくゲノム修飾による可逆的な遺伝子発現の変化であり、特にSHMT2遺伝子の発現低下が重要である」という新仮説を提出し、この遺伝子を破壊したマウスに、胎児貧血と胚致死が誘発されることも明らかにした。今回は、Shmt2遺伝子破壊マウスの胎児組織を用いた質量分析等により、この新仮説の一部を検証した。
SHMT2を欠くとエネルギー欠乏に加え細胞分化遅延
新化説のうち、「ヒトの老化に伴うエネルギー欠乏の原因として、SHMT2遺伝子の発現量低下が重要である」という部分を検証するため、研究グループはまず、Shmt2遺伝子破壊マウスを用いて、胚致死前(13.5日胚)の肝臓と脳のエネルギー産生能を調べた。その結果、肝臓で著しいエネルギー欠乏が生じていることが確認された。エネルギー欠乏は成体の造血組織である骨髄の造血細胞分化を抑制することから、胎児の造血組織である肝臓の造血細胞分化を調べたところ、Shmt2遺伝子破壊マウスの細胞分化も抑制されていた。
さらに肝臓の重量も低下しており、肝臓内にある造血細胞の細胞分裂遅延も明らかになった。マウス13.5日胚の肝臓は85%が造血細胞で構成されていることから、これらの結果は、エネルギー欠乏による造血細胞分化遅延と、造血細胞の分裂遅延が原因で、胎児貧血が誘発されたことを示している。
また、Shmt2遺伝子破壊によりどのような仕組みでエネルギー欠乏と細胞分裂阻害になるのかを質量分析等で調べた結果、グリシン枯渇のみならずタウリン枯渇とヌクレオチド枯渇も誘発されていた。タウリンはエネルギー産生に、ヌクレオチドは核酸合成に必須であるため、両者の枯渇が、それぞれエネルギー欠乏と細胞分裂遅延につながったと考えられる。
Shmt2遺伝子の働きはセリンからグリシンへの変換であるため、Shmt2破壊による胎児肝臓でのグリシン枯渇は予想通りだったが、脳ではグリシン欠乏が見られなかった。これは Shmt2遺伝子とは別の遺伝子(Gcat等)を使ってスレオニンからグリシンを得ているためと考えられる。一方、胎児の肝臓は、活発な細胞分裂と細胞分化で大量の血球を作るためにShmt2遺伝子の発現を高めており、これが原因でShmt2 遺伝子破壊が胎児貧血を誘発したと考えられた。
SHMT2発現制御は老化促進でがん化抑制の可能性も
ヒトSHMT2遺伝子の異常が原因の胎児貧血は、妊婦がグリシンを摂取することで緩和される可能性があるため、研究グループは、これについてShmt2遺伝子破壊マウスで検証していくとしている。また今回の研究により、ヒトSHMT2遺伝子の発現低下が「ヒトの老化に伴うエネルギー欠乏」のみならず、「ヒトの老化に伴う細胞分裂遅延」の原因である可能性が示唆された。したがって、グリシン摂取がこの両方を緩和することが期待される。
一方、SHMT2遺伝子の発現抑制はがん細胞の分裂速度も抑制されるという報告もある。そうだとすれば、ヒトの老化に伴うSHMT遺伝子の発現抑制は、エネルギー欠乏と細胞分裂遅延を来すという負の側面と同時に、老化とともに発症頻度が高まるがん細胞の増殖(細胞分裂)を抑制し、逆に健全な老化(長寿)に貢献している、つまり老化を促進することでがん化を抑制するという別の側面も持つ可能性がある。研究グループは、「グリシン摂取については、今後さらに、がん細胞の増殖を促進する可能性を考慮した研究が必要だ」と、述べている。
▼関連リンク
・筑波大学 注目の研究




