胆道がんで3番目に多いARID1A欠失、その分子機構は?
東京医科歯科大学は11月6日、胆管がんにおいてARID1Aの欠失が、幹細胞遺伝子のALDH1A1の発現を亢進し、胆管がんの悪性度に関連していることを世界で初めて明らかにしたと発表した。この研究は、同大大学院医歯学総合研究科分子腫瘍医学分野の田中真二教授、秋山好光講師、島田周助教、吉野潤大学院生の研究グループが、同ウイルス制御学の山岡昇司教授、同肝胆膵外科学分野の田邉稔教授との共同研究で行ったもの。研究成果は、国際科学誌Carcinogenesis(カルシノジェネシス)オンライン版に掲載されている。
画像はリリースより
胆道がんは世界的に増加傾向で、特に日本を含むアジアで発症頻度が高い悪性腫瘍。発生部位により肝内胆管がん、肝外胆管がん、胆嚢がんに分けられ、それぞれ異なった遺伝学的背景や臨床経過を呈する。肝内胆管がんは胆道がんの約10%を占め、その悪性度は高く、切除後5年生存率は25~35%だ。現在、胆道がんに対して有効な薬剤は少なく、新たな治療薬の開発が待ち望まれている。胆道がんの大規模遺伝子解析の結果、エピジェネティック制御遺伝子の異常が高頻度に認められており、特にARID1A変異の割合は約11%を占め、TP53、KRASに続いて3番目に頻度が高いことが報告されている。しかしながら、胆道がんにおけるARID1A欠失による分子機構はよくわかっていなかった。
エピジェネティック制御遺伝子ARID1Aの発現低下は肝内胆管がんの悪性化に関与
今回研究グループは、胆道がんにおけるARID1Aの発現異常と臨床病理学的諸性状との関連を調べ、ARID1A発現低下は肝内胆管癌患者の予後に関与していることを明らかにした。胆道がんの臨床症例を用いた解析から、ARID1A発現の陰性症例が胆道がん120例中21例(17.5%)で認められ、その内訳は肝内胆管がんが15/69例(21.7%)、肝外胆管がんが4/34例(11.8%)、胆嚢がんは2/17例(11.8%)であり、ARID1A発現欠失は肝内胆管がんで最も多くみられた。ARID1A発現と臨床病理学的諸性状との関連を検討した結果、予後因子のみに有意差が認められ、ARID1A陰性胆管癌群は陽性群に比べて予後が不良だった(P=0.005)。
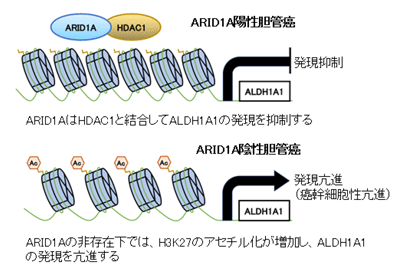
胆管がんにおけるARID1A欠失の生物学的意義を調査するため、ゲノム編集法を用いてARID1Aノックアウト胆管がん細胞株を作成。ARID1Aノックアウト株の遊走能、浸潤能とスフェア形成能はARID1A野生型細胞に比べて有意に高く、ARID1A欠失は胆管がんの悪性度亢進に関与することが明らかになった。さらに網羅的遺伝子発現およびシグナル経路解析により、ARID1Aノックアウト細胞では幹細胞性や浸潤亢進に関わる複数の遺伝子群が同定され、その中でも幹細胞遺伝子であるALDH1A1の発現亢進が最も大きな変化だった。ARID1Aノックアウト細胞では、ALDH1A1遺伝子のプロモーター領域のヒストンH3の27番目リジン(K27)のアセチル化(H3K27ac)レベルが野生型細胞に比べて強く、ALDH1A1の発現亢進にはヒストンアセチル化の増強が関与することがわかった。一方、ARID1A 存在下では、ARID1A はヒストン脱アセチル化酵素HDAC1と結合して複合体を作った。さらにARID1A・HDAC1複合体によるヒストン脱アセチル化の促進により、ALDH1A1遺伝子のプロモーター領域のH3K27acレベルが減少することが示唆された。臨床検体を用いた解析でも同様にALDH1A1とARID1Aとの発現は逆の関係であり(P=0.018)、ARID1A陰性かつALDH1A1陽性群はそれ以外の症例群に比べて有意に予後不良だった。(P=0.002)。
今回の研究では、肝内胆管がんにおいてARID1Aの発現低下が悪性化に関与していることを見出した。そして、ARID1AはHDAC1と結合してヒストン脱アセチル化を促進させ、ALDH1A1発現を抑制していることが明らかになった。ARID1Aが欠失した胆管がんではヒストンアセチル化レベルが高く、ALDH1A1の発現亢進によって幹細胞性が増強するという機序が示唆された。研究グループは、「今後、ARID1Aによるヒストン修飾異常を標的とした新規治療法の開発が期待される」と、述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース




