レビー小体の形成、黒質ドパミン神経の脱落、両方を再現
大阪大学は10月24日、人工的に合成したαシヌクレイン凝集体を直接マウス脳に接種することで、パーキンソン病の病理学的特徴であるレビー小体の形成と、それに続く進行性のドパミン神経の脱落を再現し、よりヒトのパーキンソン病病態に近い優れたモデルの作製に成功したと発表した。この研究は、同大大学院医学系研究科の馬場孝輔特任講師らの研究グループによるもの。研究成果は、米国科学誌「Movement Disorders」電子版に掲載されている。
画像はリリースより
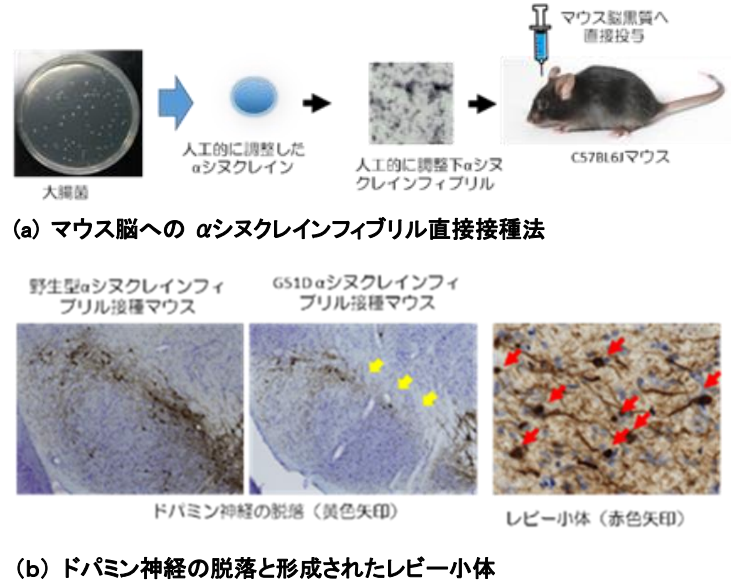
パーキンソン病の病理学的特徴は、黒質ドパミン神経の変性とレビー小体の形成だ。そのレビー小体の主要構成成分がαシヌクレインである。αシヌクレインが神経細胞内でミスフォールドし、重合して凝集体を形成、細胞毒性を発揮、さらに細胞間を伝搬することで病態が進行するという“プリオン仮説”が現在のパーキンソン病の病態仮説の主流となっている。近年、αシヌクレインのプリオン仮説に基づくモデル動物の作製、つまりin vitroで調整したαシヌクレイン凝集体をマウス脳へ直接接種する方法論による研究が広く行われている。しかし、これまで、通常の(野生型)αシヌクレイン凝集体を用いた研究では、αシヌクレインの蓄積によるレビー小体の形成と緩徐進行性の黒質ドパミン神経の脱落の両方を完全に再現した結果はなかった。
αシヌクレインの凝集体の立体構造が病態に大きく影響
研究グループは、野生型αシヌクレインではなく、重症の遺伝性パーキンソン病患者で確認されているG51D遺伝子変異に着目。G51D変異αシヌクレインが重合した凝集体を人工的に調整し、タンパク質の構造解析を行ったところ、変異のない(野生型)αシヌクレインと比較して、βシート構造含有率が約2倍であることが判明。βシート構造は、異常プリオンタンパク質などの病的タンパク質の構造的特徴の一つである。このG51D変異αシヌクレイン凝集体をマウスの片側黒質へ接種し、経時的に評価した結果、野生型αシヌクレイン凝集体と比べて、広範な脳領域にレビー小体の形成を確認。さらに接種後12週目から黒質ドパミン神経の脱落が始まり、24週では約70%の脱落を認めたという。
今回の研究成果は、パーキンソン病の病態にαシヌクレインの凝集体の立体構造が大きく影響することを示した重要な知見。今回作製したマウスは、緩徐進行性のレビー病理、黒質ドパミン神経の脱落を再現しており、αシヌクレインを原因とする他の神経疾患(レビー小体型認知症や多系統萎縮症)の病態解明にも寄与することが期待される。また、パーキンソン病の新たな進行抑制を可能とする病態修飾療法の開発、発症機序の解明に寄与するツールとしてパーキンソン病研究の発展に寄与すると考えられる。「遺伝子改変を必要としないため、原理的には霊長類モデルへの展開も可能である」と、研究グループは述べている。
▼関連リンク
・大阪大学 研究情報




