免疫関連有害事象抑制にステロイド剤投与、腫瘍免疫応答への影響は?
名古屋大学は10月18日、ステロイド剤が免疫関連有害事象に関連するような自己抗原に対する親和性が低いCD8陽性T細胞に対して選択的に脂肪酸酸化代謝経路を阻害することでCD8陽性記憶前駆T細胞への分化を抑える一方で、がん細胞を殺傷するようながん抗原特異的T細胞の中の記憶免疫細胞を阻害しないことで、長期的ながん殺傷効果が維持されることを明らかにしたと発表した。この研究は、同大大学院医学系研究科分子細胞免疫学(国立がん研究センター研究所腫瘍免疫研究分野分野長兼任)の西川博嘉教授、杉山大介特任助教らの研究グループによるもの。研究成果は「The Journal of Experimental Medicine」に掲載されている。
画像はリリースより
現在、がんに対する治療法として、体内の免疫反応を利用した「がん免疫療法」が注目されている。その中でも、本来なら過剰な免疫反応を抑える免疫チェックポイント分子が、がん細胞に対する特異的なT細胞で発現していることから、「免疫チェックポイント分子阻害剤」が開発され、さまざまながん種で治療効果を示すことが明らかになっている。がん免疫療法を受ける患者の一部では、過剰な免疫反応によって引き起こされる間質性肺炎や内分泌障害といった免疫関連有害事象がある。これらの免疫関連有害事象を抑えるためにステロイド剤が投与されるが、ステロイド剤投与による免疫抑制作用によって免疫チェックポイント分子阻害剤によるがんに対する免疫応答の増強効果が弱まる可能性もある。
そこで今回研究グループは、ステロイド剤が免疫チェックポイント分子阻害剤の治療効果に与える影響について検討し、ステロイド剤が免疫を抑制する仕組みを解明することで、免疫チェックポイント分子阻害剤治療時の最適なステロイド剤投与方法の確立を目的とし、研究を行った。
ステロイドは抗原低親和性CD8+T細胞の記憶細胞への分化を選択的に阻害
研究グループはまず、マウス線維肉腫細胞株CMS5a-NYESO-1を移植した担がんマウスモデルを用いて、ステロイド剤の一種であるメチルプレドニゾロンを投与することで、免疫チェックポイント分子阻害剤の一種である抗CTLA-4抗体の治療効果にどのような影響を与えるかを検討した。このとき、ステロイド剤の投与量による影響も考慮し、低容量と高容量を設定した。その結果、抗CTLA-4抗体治療開始時にステロイド剤を投与した場合には、高用量のステロイド剤を投与した群でがんが悪化してきたが、がんが完全に消失してからステロイド剤を投与した場合には投与量に関係なくがんの再発は認められなかった。
がん免疫療法治療の特徴の一つとして抗腫瘍効果が長期間持続することが知られており、これはがん細胞に対する細胞傷害性CD8陽性T細胞(CD8+T細胞)が記憶免疫細胞に分化し、がん細胞を持続的に排除しているためと考えられている。そのため、ステロイド剤は抗CTLA-4抗体治療で誘導/活性化されるCD8+T細胞の中でも記憶免疫細胞への分化に影響を与えていると研究グループは考え、がんが完全に消失した後に再度がん細胞を移植した。このとき、CMS5a-NYESO-1(強いがん抗原が存在する細胞株)と、CMS5a(強いがん抗原が存在しない細胞株)を使用した。その結果、CMS5a-NYESO-1を移植した場合、がん細胞は完全に拒絶されたが、CMS5aを移植した場合は容量に関わらずステロイド剤を投与されていたマウスにおいて、がんの増殖抑制効果が認められなかった。この結果から、ステロイド剤は抗原への反応性が低いCD8+T細胞(低親和性CD8+T細胞)の記憶免疫細胞への分化を選択的に阻害していることが示唆された。
次に、ステロイド剤がどのようにしてCD8+T細胞の記憶免疫細胞への分化を阻害しているかを検討するため、抗CTLA-4抗体治療後のがん組織浸潤CD8+T細胞の記憶免疫細胞への分化を解析。その結果、ステロイド剤を投与することでCD127highKLRG1lowを示す記憶前駆細胞(memory precursor effector cells;MPECs)のうち低親和性 CD8+T 細胞の数ががん組織中で減少していることがわかった。一方で、がん細胞への反応性が高いCD8+T細胞(高親和性CD8+T細胞)のMPECsはステロイド剤の影響を受けなかった。
さらに、ステロイド剤がMPECsを減少させるメカニズムを解明するため、低親和性抗原特異的CD8+T細胞の機能に関係している遺伝子を網羅的に解析。その結果、ステロイド剤を作用させることで脂肪酸酸化代謝に関係する遺伝子の発現が低下していることが判明した。この遺伝子解析結果を元に、CMS5a-NTESO-1を移植した担がんマウスにおけるがん組織浸潤CD8+T細胞の詳細な解析を行ったところ、低親和性CD8+T細胞の脂肪酸酸化代謝関連遺伝子の発現が低下していることが明らかになった。
ヒトでも低親和性CD8+T細胞の記憶細胞抑制を示唆する結果
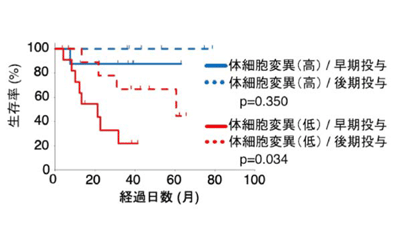
最後に、このマウスモデルでの実験結果をヒトで検証するため、抗CTLA-4抗体治療を受けた悪性黒色腫患者の検体を解析した。がん細胞の体細胞遺伝子変異量が多いほど治療効果が良い傾向にあり、これは免疫系が、体細胞遺伝子変異量が多いがん細胞を異物と認識しやすいため、攻撃する高親和性CD8+T細胞が多数誘導されるからと考えられている。体細胞遺伝子変異解析とステロイド剤の投与歴を元に患者の生存率を調べたところ、体細胞遺伝子変異量が低い患者で、早期のステロイド剤投与により生存率が低くなる傾向にあることがわかった。これにより、ヒトにおいてもステロイド剤は低親和性CD8+T細胞の記憶免疫細胞機能を抑制することで、長期的な免疫チェックポイント分子阻害剤の治療効果を弱めることが示唆された。
今回の研究成果は、がん免疫療法を受ける患者で免疫関連有害事象が見られた場合、体細胞遺伝子変異量や投与時期を考慮した上で、適切なステロイド剤を投与する必要があることを示している。研究グループは今後、大規模な臨床研究を実施し、ステロイド剤によるがん免疫療法の治療効果に対する影響を解明し、将来的にはそれぞれの患者に適したステロイド剤投与方法の確立を目指すとしている。
▼関連リンク
・名古屋大学 プレスリリース



