CYLDと相互作用するE3リガーゼのスクリーニングを実施
愛媛大学は10月15日、E3リガーゼMIB2が脱ユビキチン化酵素CYLDを分解することにより、炎症を促進することを見出したと発表した。この研究は、同大プロテオサイエンスセンターの澤崎達也教授らの研究グループによるもの。研究成果は「The journal of biological chemistry」に掲載されている。
画像はリリースより
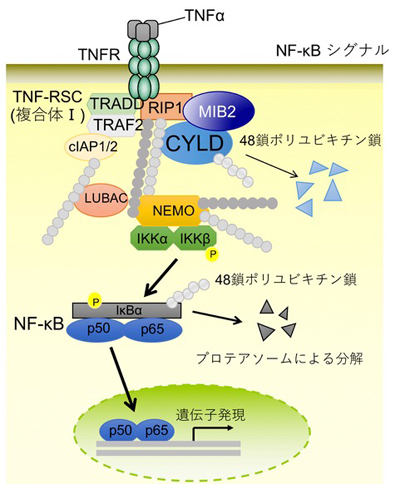
NF-κBは、炎症性サイトカインなどの多様な刺激によって活性化され、種々の遺伝子発現を亢進させることで炎症や免疫応答、細胞増殖などさまざまな生命現象を調節する転写因子。恒常的に活性化したNF-κBは、自己免疫疾患やがんなどのさまざまな疾患に関与していることが報告されている。
また、NF-κBは翻訳後修飾系の一種として知られるユビキチン化依存的なシグナル伝達経路であることが明らかになってきている。ユビキチンが複数つながったポリユビキチン鎖は、タンパク質の分解のみならず、タンパク質の活性化・転写調節など多様な様式でタンパク質の機能を制御する。CYLDに代表されるようなポリユビキチン鎖を切断する脱ユビキチン化酵素は、シグナル活性を負に制御することによりNF-κBの転写活性を調節している。一方で、CYLDタンパク質の分解がNF-κBシグナルの恒常的な活性化を引き起こすことが明らかになっている。プロテアソームによるタンパク質分解にはユビキチン化する特異的なE3リガーゼが必要だが、CYLDを分解誘導しNF-κBを活性化させるE3リガーゼは同定されていなかった。そこで研究グループは、NF-κBシグナルにおいてCYLD分解誘導による抑制制御機構を解明するため、CYLDと相互作用するE3リガーゼのスクリーニングを実施した。
CYLDの1アミノ酸置換変異による家族性円柱腫症発症機構のモデルを提示
その結果、研究グループはNF-κBシグナルへの関与報告のあったE3リガーゼMIB2を見出した。複数種類のヒトがん由来培養細胞を用いて、MIB2がユビキチン化を付加しCYLDを分解すること、MIB2がCYLDの分解によりNF-κBシグナルの活性化を誘導すること、MIB2ノックアウトマウスが関節炎抑制の表現形を示すことを明らかにしたという。
また、CYLD遺伝子が欠損や点変異すると円柱腫につながることが知られているが、点変異で円柱腫瘍が誘導される理由は明らかになっていなかった。研究グループは、遺伝性疾患の家族性円柱腫症の患者から見出されたCYLD変異体(P904L)が、MIB2により優先的に分解されることを発見。これまで未解明だったCYLDの1アミノ酸置換変異による家族性円柱腫症発症機構のモデルを提示したとしている。
▼関連リンク
・愛媛大学 プレスリリース



