胎児の手足などに奇形が生じる問題がある一方で、多発性骨髄腫などへの治療効果も
東京医科大学は10月8日、サリドマイドの催奇形性の詳細なメカニズムを明らかにしたと発表した。この研究は、同大ナノ粒子先端医学応用講座(現・ケミカルバイオロジー講座)の半田宏特任教授(東京工業大学名誉教授)と伊藤拓水准教授、東京工業大学・生命理工学院の山口雄輝教授、イタリア・ミラノ大学のルイーサ・ゲリーニ博士らの国際共同研究グループによるもの。研究成果は「Nature Chemical Biology」にて公開された。
サリドマイドは、1950年代に鎮静剤として開発され、日本を含む40数か国で販売された薬剤。同剤を妊娠初期の女性が服用すると胎児の手足や耳などに奇形が生じたことから、世界的な薬害事件に発展し、1960年代前半に市場から撤退した。その後、同剤がハンセン病や多発性骨髄腫などの難治性疾患に対して優れた治療効果を示すことがわかり、厳格な統制の下での投与が再び認可されている。しかし、サリドマイド催奇形性のメカニズムは明らかになっていなかった。
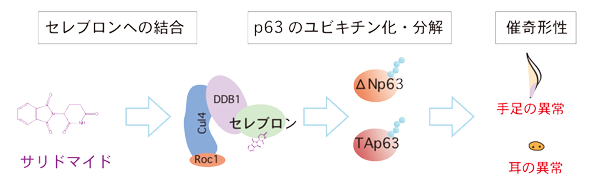
研究グループは、独自技術を用いた薬剤標的因子の探索・同定に長年携わり、2010年に同剤の主要な細胞内標的因子がタンパク質セレブロンだと突き止めた。セレブロンはタンパク質分解に関わるユビキチンリガーゼという酵素の構成因子だ。その後の研究で、サリドマイド系の化合物がセレブロンに結合するとセレブロンの基質特異性が変化して、通常は分解されないタンパク質が分解されるようになることが明らかとなっていた。また、サリドマイド系化合物CC-885がセレブロンに結合するとタンパク質GSPT1の分解が引き起こされ、CC-885の急性白血病に対する治療効果に関わっていることを発見。GSPT1のようなタンパク質はセレブロンのネオ基質と呼ばれる。しかし、サリドマイドの催奇形性に関わるセレブロンのネオ基質は明らかになっていなかった。
タンパク質p63の分解が手足や耳の奇形の原因と判明
今回研究グループは、サリドマイドの催奇形性に関わるネオ基質がタンパク質p63であることを見出した。p63には大小の2つのタイプがあるが、胎児の発生過程で小さい方が手足の形成に、大きい方が耳の形成に重要な役割を果たしている。脊椎動物のモデル生物であるゼブラフィッシュを用いた解析により、サリドマイドがセレブロンに結合するとp63の大小両方の分解が誘導され、その結果、手足や耳の奇形が引き起こされることが明らかとなった。
画像はリリースより
近年、サリドマイド骨格をもつ医薬品の研究開発が精力的に進められているが、催奇形性のないサリドマイド系化合物はいまだに見つかっておらず、それらの処方は各国の法規に基づく厳格な統制のもと行われている。今回の研究により、p63の分解が副作用の原因であることが判明したため、p63の分解を誘導しないサリドマイド系化合物を探索することにより、安全性の高い新薬の開発が今後期待される、と研究グループは述べている。
▼関連リンク
・東京医科大学 プレスリリース




