プラズマ活性培養液とプラズマ活性乳酸リンゲル液の作用機序を調査
名古屋大学は9月24日、プラズマ活性培養液(Plasma-activated medium, PAM)とプラズマ活性乳酸リンゲル液(Plasma-activated Ringer’s lactate solution, PAL)は、全く異なる細胞内分子機構によりがんを殺傷することを新たに発見したと発表した。この研究は、同大低温プラズマ科学研究センターの堀勝教授、田中宏昌准教授らの研究グループが、同大医学部附属病院の水野正明教授、同医学部の吉川史隆教授、豊國伸哉教授と共同で行ったもの。研究成果は、英国科学雑誌「Scientific Reports」オンライン版に掲載されている。
画像はリリースより
近年、大気圧低温プラズマを用いた医療研究が盛んに行われている。同大はこれまでに、独自に開発した超高密度プラズマ発生装置を用いたがん治療研究、特にプラズマ活性溶液による脳腫瘍、卵巣がん、胃がんの治療研究において数多くの研究成果を挙げてきた。2012年度には文部科学省のプロジェクトである新学術領域「プラズマ医療科学の創成」(領域代表:堀勝教授)が発足。2013年、世界に先駆けて「プラズマ活性培養液」による抗腫瘍効果を報告すると、世界中でプラズマ活性溶液の研究が活発に進められるようになった。2016年には新種のプラズマ活性溶液である「プラズマ活性乳酸リンゲル液」による抗腫瘍効果を報告。これらを含むプラズマ照射した溶液を総称して「プラズマ活性溶液」と呼ぶ。これまでに世界中でさまざまなプラズマ活性溶液が開発されてきたが、それぞれのプラズマ活性溶液がどのような細胞内分子機構でがんを殺傷するかは解明されていなかった。
PAMは酸化ストレス依存性の細胞死を誘導、PALは酸化ストレス非依存性の細胞死を誘導
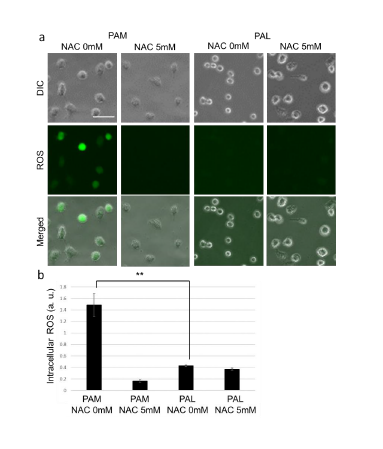
研究グループは始めに、同一の条件でPAMとPALを作製。脳腫瘍培養細胞内にどの程度、活性酸素種を誘導するのかを調べたところ、PAMはPALに比べ、脳腫瘍培養細胞に対してより多くの活性酸素種を誘導することを発見した。
次に、PAMを投与された脳腫瘍培養細胞の遺伝子発現がどのように変わるかをマイクロアレイ解析したところ、61の遺伝子で2倍以上遺伝子発現が上昇することを突き止めた。これらの遺伝子には、Growth Arrest and DNA Damage(GADD)誘導遺伝子として知られるGADD45α遺伝子やGADD45β遺伝子といった、GADD45シグナル伝達経路に関わる多くの遺伝子が含まれていた。GADD45シグナル伝達経路は酸化ストレスに応答して、細胞周期の進行を止めたり、プログラム細胞死として知られるアポトーシスを誘導したりすることで良く知られていることから、PAMによる脳腫瘍細胞への細胞死は、細胞内に生じた酸化ストレスを通じたGADD45シグナル伝達経路の誘起によるものである可能性が示唆された。
一方で、PALを投与した脳腫瘍培養細胞においては、これらのGADD45シグナル伝達経路に関わる遺伝子発現は上昇しないことがわかった。以上の結果から、PAMは酸化ストレス依存性の細胞死を誘導し、PALは酸化ストレス非依存性の細胞死を誘導すると結論した。
近年、がん細胞の薬剤耐性が問題となっており、そのメカニズム解明が話題となっている。プラズマ活性溶液の細胞内分子機構の違いを調べることで、各種プラズマ活性溶液を使い分けることができるようになれば、個別化医療に基づくがん治療戦略を練ることが可能になると期待される。
▼関連リンク
・名古屋大学 プレスリリース




