MAPT遺伝子の「タウR406W」変異がアルツハイマー症状と関連
慶應義塾大学は9月20日、家族性の前頭側頭葉変性症(frontotemporal lobar degeneration、以下FTLD)の患者よりiPS細胞を樹立し、神経細胞へと分化させることで、その病態メカニズムの一端を解明したと発表した。この研究は、同大医学部生理学教室の岡野栄之教授、中村真理准訪問研究員、同総合医科学研究センターの塩澤誠司特任講師らを中心とする研究グループによるもの。研究成果は「Stem Cell Reports」に掲載されている。
画像はリリースより
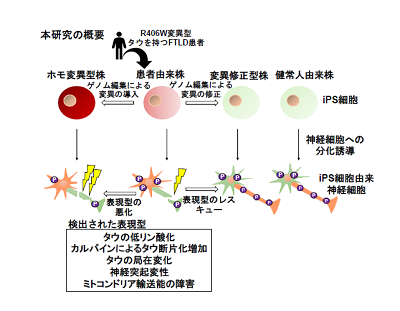
FTLDは、老年期に脳の前頭葉や側頭葉の神経細胞死によって起こる認知症のひとつ。アルツハイマー病では記憶の障害が主であるのに対して、FTLDでは人格の変化や行動異常などが引き起こされることを特徴としている。いずれの認知症でも、病理学的には異常なタウタンパク質の蓄積が認められており、病気の発症と関連があると考えられているが、詳細なメカニズムは不明だった。 家族性のFTLDでは、タウタンパク質をコードするMAPT遺伝子に変異があると、脳の神経細胞死を引き起こし、遺伝性のFTLDを発症する。MAPT遺伝子の変異にはさまざまな種類があり、その中でもタウR406Wというアミノ酸変異を持つ場合には、アルツハイマー病によく似た症状を示すことが知られている。
タウタンパク質の異常やミトコンドリアの輸送異常が発症との関わり示す
研究では、MAPT遺伝子の片側のみタウR406W変異を持つ患者由来のiPS細胞(ヘテロ変異型)を樹立。比較のため、変異を持たない人のiPS細胞(健常人)、ヘテロ変異型患者由来の変異をゲノム編集技術により修正したiPS細胞(変異修正型)、タウR406W変異を両側の遺伝子に持つiPS細胞(ホモ変異型)も樹立した。 これらのiPS細胞から、脳オルガノイドと呼ばれる脳に類似した組織をそれぞれ作成し、その神経細胞を詳しく分析。 その結果、3つのことが明らかになった。1)タウR406W変異の神経細胞では、タウタンパク質が異常な低リン酸化状態になっていること、2)タウR406W変異を持たない対照群に比べて断片化されたタウタンパク質が増えていること、3)このタウタンパク質の断片化は、タンパク質切断酵素であるカルパインによる切断であること。
また通常、タウタンパク質は神経細胞の軸索と呼ばれる部分に存在するが、この変異を持つ患者のiPS細胞由来神経細胞では、細胞体および樹状突起に存在する比率が増加していた。さらに、タウR406W変異を持った神経細胞では軸索が細切れになっており、細胞内小器官のひとつであるミトコンドリアの輸送に異常が生じていることが明らかになったが、微小管安定化剤を加えることで正常になった。
今回の研究結果により、神経細胞のタウタンパク質の異常やミトコンドリアの輸送異常が、タウR406W変異を持つFTLDの病態の一端になっていると考えられる。「研究成果によって、タウタンパク質が原因となる病気の治療薬や病気の進行を抑える薬の開発に役立つことが期待される」と、研究グループは述べている。
▼関連リンク
・慶應義塾大学 プレスリリース



